
分析 (1)②SO2的S元素化合价处于中间价态,既具有氧化性也具有还原性,将SO2通入酸性KMnO4溶液中,被氧化,S元素化合价升高;
(2)①SiO2只能与碱反应生成盐和水,Al2O3和酸碱反应生成盐和水属于两性氧化物;
②Ⅰ.先将其溶于过量的盐酸中,滤渣为与盐酸不反应的物质;
Ⅱ.再向滤液中加入NaOH溶液至过量,氯化铝生成偏铝酸钠,滤渣为氢氧化镁和氢氧化铁;
解答 解:(1)②SO2的S元素化合价处于中间价态,既具有氧化性也具有还原性,将SO2通入酸性KMnO4溶液中,被氧化,S元素化合价升高,被氧化生成SO42-,
故答案为:B;
(2)①SiO2只能与碱反应生成盐和水,则属于酸性氧化物,Al2O3和酸碱反应生成盐和水属于两性氧化物,
故答案为:酸性;两性;
②I.先将其溶于过量的盐酸中,滤渣为与盐酸不反应的物质,应为SiO2,
故答案为:SiO2;
II.加入盐酸后,滤液中含有氯化铝、氯化镁和氯化铁,再向滤液中加入NaOH溶液至过量,氯化铝生成偏铝酸钠,滤渣为氢氧化镁和氢氧化铁,
故答案为:Fe(OH)3和Mg(OH)2;
点评 本题考查氧化还原反应,明确元素的化合价与元素性质之间的关系是解本题关键,知道酸性氧化物和碱性氧化物概念,题目较简单.


 天天向上课时同步训练系列答案
天天向上课时同步训练系列答案 阳光课堂同步练习系列答案
阳光课堂同步练习系列答案科目:高中化学 来源: 题型:解答题
| 离子 | K+ | Na+ | NH4+ | H+ | SO42- | NO3- | Cl- |
| 浓度/mol•L-1 | 4×10-6 | 6×10-6 | 2×10-5 | a | 4×10-5 | 3×10-5 | 2×10-5 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH3COOH+CH3CH2OH $?_{△}^{浓硫酸}$CH3COOCH2CH33+H2O | |
| B. | CH2═CH2+HBr→CH3CH2Br | |
| C. | CH4+Cl2$\stackrel{光}{→}$CH3Cl+HCl | |
| D. | 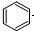 +Br2$\stackrel{FeBr_{3}}{→}$ +Br2$\stackrel{FeBr_{3}}{→}$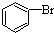 +HBr +HBr |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 9:4 | B. | 6:1 | C. | 7:6 | D. | 11:6 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③④ | B. | ①③ | C. | ②④ | D. | ①③⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 56克亚铁离子得到2NA个电子被还原成单质 | |
| B. | 1L 1mol/L的KCl溶液中含Cl-的物质的量为NA | |
| C. | 在25℃、1.01×105Pa的条件下,2.24LCO2中含有的原子数大于0.3NA | |
| D. | 0.1mol/L的氯化钡溶液中氯离子的数目是0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 钠与氧气反应时,产物只有一种 | |
| B. | 铝箔在空气中受热可以熔化且会发生剧烈燃烧 | |
| C. | 金属与非金属发生反应时,被氧化的一定是金属 | |
| D. | 铁丝不论在空气中还是纯氧中都不会燃烧 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com