
(12分)铬铁矿主要成分为FeO·Cr2O3,含有SiO2、Al2O3等杂质。工业上用铬铁矿制备红矾钠(Na2Cr2O7)的流程如下图所示:
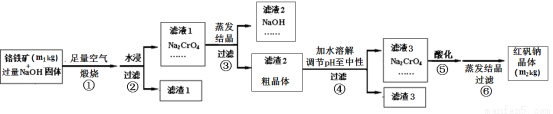
煅烧时反应为:4 FeO·Cr2O3+7 O2 +20 NaOH 8 Na2CrO4 + 4 NaFeO2+10 H2O
8 Na2CrO4 + 4 NaFeO2+10 H2O
(1)步骤①是在坩埚中进行煅烧,可用作此坩埚材料的是 。
A.铁 B.氧化铝 C.石英 D.陶瓷
(2)步骤①煅烧反应极慢,需要升温至NaOH呈熔融状态,反应速率才加快,其原因为______。
(3)步骤②中NaFeO2会强烈水解生成氢氧化铁沉淀,其化学方程式为 。
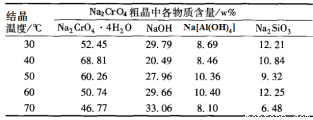
(4)将五份滤液1分别在130℃蒸发1小时,各自冷却到不同温度下结晶,保温过滤,所得实验数据如下表。根据数据分析,步骤③的最佳结晶温度为___________。
(5)步骤④中滤渣3的成分是_________________________。
(6)假设该流程中铬元素完全转化为红矾钠,则该铬铁矿中铬元素的质量分数为_____(用含m1、m2的代数式表示)。
(1)A (1分)(2)熔融后增大了反应物的接触面积 (2分)
(3)NaFeO2 + 2H2O = Fe(OH)3↓ + NaOH (2分) (4) 40(2分)
(5)Fe(OH)3 、H2SiO3 (或H4SiO4 )(2分)(6)52m2/131m1 (2分)
【解析】
试题分析:(1)氧化铝、二氧化硅在加热的条件下均能与氢氧化钠反应,所以煅烧时不能用氧化铝、石英、陶瓷坩埚,而应该用铁坩埚,答案选A。
(2)氢氧化钠熔融后增大了反应物的接触面积,因此反应速率加快。
(3)NaFeO2会强烈水解生成氢氧化铁沉淀,则根据原子守恒可知还有氢氧化钠生成,所以化学方程式为NaFeO2 + 2H2O = Fe(OH)3↓ + NaOH。
(4)根据表中数据可知冷却到40℃时铬酸钠晶体的含量最高,因此步骤③的最佳结晶温度为40℃。
(5)在生成铬酸钠晶体的同时NaFeO2也会水解生成氢氧化铁沉淀,同时溶液中的硅酸钠转化为硅酸沉淀,所以步骤④中滤渣3的成分是Fe(OH)3 、H2SiO3 (或H4SiO4 )。
(6)红矾钠(Na2Cr2O7)的质量是m2kg,其中铬元素的质量是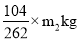 ,所以该铬铁矿中铬元素的质量分数为
,所以该铬铁矿中铬元素的质量分数为 =52m2/131m1。
=52m2/131m1。
考点:考查物质制备工艺流程图的分析与应用


科目:高中化学 来源:2014-2015广东省汕头市高二上学期月考化学(文)试卷(解析版) 题型:?????
下列实验操作或事故处理正确的是
A.金属钠着火,立即用水扑灭
B.实验结束后,用嘴吹灭酒精灯
C.皮肤不慎沾上NaOH溶液,立即用盐酸冲洗
D.稀释浓硫酸时,将浓硫酸沿器壁慢慢注入水中,并不断搅拌
查看答案和解析>>
科目:高中化学 来源:2014-2015广东省汕头市高二上学期月考化学(理)试卷(解析版) 题型:选择题
下列有关AgCl沉淀的溶解平衡说法正确的是
A.AgCl溶液中,c(Cl—)×c(Ag+)是一个定值
B.AgCl难溶于水,溶液中没有Ag+和Cl—
C.升高温度,AgCl沉淀的溶解度增大
D.向AgCl沉淀中加入NaCl固体,沉淀的溶解度不变
查看答案和解析>>
科目:高中化学 来源:2014-2015广东省汕头市高二上学期月考化学(理)试卷(解析版) 题型:选择题
下列溶液中一定呈中性的是
A.pH=7的溶液
B.由强酸、强碱等物质的量反应得到的溶液
C.c(H+)=c(OH—)的溶液
D.非电解质溶于水得到的溶液
查看答案和解析>>
科目:高中化学 来源:2014-2015福建省厦门市高三上学期期末质量检查化学试卷(解析版) 题型:选择题
25℃时,相同pH值的两种一元弱酸HA与HB溶液分别加水稀释,溶液pH值随溶液体积变化的曲线如图所示。

下列说法正确的是
A.同浓度的NaA与NaB溶液中,c(A-) 小于c(B-)
B.a点溶液的导电性大于b点溶液
C.a点的c(HA)大于b点的c(HB)
D.HA 的酸性强于HB
查看答案和解析>>
科目:高中化学 来源:2014-2015福建省厦门市高三上学期期末质量检查化学试卷(解析版) 题型:选择题
安全气囊碰撞时发生反应:10NaN3+2KNO3=K2O+5Na2O+16N2↑ ,下列判断正确的是
A.每生成16 mol N2转移30 mol电子 B.NaN3中N元素被还原
C.N2既是氧化剂又是还原剂 D.还原产物与氧化产物质量之比为1:15
查看答案和解析>>
科目:高中化学 来源:2014-2015北京市高二上学期期中考试化学(文)试卷(解析版) 题型:选择题
下列行为符合安全要求的是
A.配制稀硫酸时将水倒入浓硫酸中并不断搅拌
B.不慎洒出的酒精在桌上着火时,立即用水扑灭
C.大量氯气泄漏时,迅速离开现场并尽量往高处去
D.少量浓硫酸沾在皮肤上,立即用大量氢氧化钠溶液冲洗
查看答案和解析>>
科目:高中化学 来源:2014-2015北京市高二上学期期中考试化学(理)试卷(解析版) 题型:选择题
可逆反应:X+Y W+Z,反应速率(V)随时间(t)变化的情况如图所示。
W+Z,反应速率(V)随时间(t)变化的情况如图所示。 表示在其他条件不变的情况下,改变体系的一个条件(温度、浓度、压强)所引起的变化。则下列分析正确的是
表示在其他条件不变的情况下,改变体系的一个条件(温度、浓度、压强)所引起的变化。则下列分析正确的是

A.t0时条件改变引起的变化是平衡向正反应方向移动
B.若t0改变的条件是压强,则W、Z均为气体,X、Y中只有一种为气体
C.若t0改变的条件是温度,则该反应的正反应是吸热反应
D.若t0改变的条件是浓度,改变的方法是减小X、Y的浓度
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com