
【题目】根据下列实验事实,不能得到相应结论的是
选项 | 实验操作和现象 | 结论 |
A | 向醋酸溶液中滴加少量Na2SiO3溶液,观察到白色沉淀 | 醋酸的酸性强于H2SiO3 |
B | 向均盛有2mL5% H2O2溶液的两支试管中分别滴入0.2mol/LFeCl3和0.3mol/LCuCl2溶液各1mL,前者生成气泡的速率更快 | 催化效果: Fe3+> Cu2+ |
C | 向一定浓度的醋酸溶液中加入镁条,产生气泡的速率会先加快再减慢 | 反应产生气泡速度变化,是因为醋酸电离平衡先正向移动,再逆向移动 |
D | 常温下分别测等浓度的醋酸和氨水pH,二者的pH 分别为2和12 | 常温下,醋酸和氨水的电离平衡常数相等 |
A. A B. B C. C D. D
【答案】C
【解析】A. 向醋酸溶液中滴加少量Na2SiO3溶液,生成硅酸白色沉淀,表明醋酸的酸性强于H2SiO3,故A能得到相应结论;B. 向均盛有2mL5%H2O2溶液的两支试管中分别滴入0.2mol/LFeCl3和0.3mol/LCuCl2溶液各1mL,FeCl3的物质的量小于CuCl2,前者生成气泡的速率更快,表明催化效果:Fe3+>Cu2+,故B能得到相应结论;C. 向一定浓度的醋酸溶液中加入镁条,产生气泡的速率会先加快再减慢,反应产生气泡速度变化,是因为反应放热使反应速率加快,随着反应进行,醋酸浓度减小使反应速率减慢,故C不能得到相应结论;D. 常温下等浓度的醋酸和氨水的pH分别为2和12,前者c(CH3COO-)=c(H+)=1×10-2mol/L,后者c(![]() )=c(OH-) =
)=c(OH-) =![]() =
=![]() mol/L=1×10-2mol/L,Ka=
mol/L=1×10-2mol/L,Ka=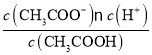 ,一水合氨的电离常数Kb=
,一水合氨的电离常数Kb=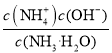 ,Ka= Kb,故D能得到相应结论。故选C。
,Ka= Kb,故D能得到相应结论。故选C。


科目:高中化学 来源: 题型:
【题目】某同学查阅教材得知,普通锌锰电池筒内无机物的主要成分为MnO2、NH4C1、ZnCl2等。他在探究废干电池内的黑色固体回收利用时,进行如图所示实验。下列有关实验的叙述不正确的是
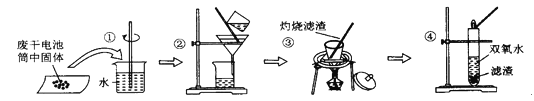
A. 操作①中玻璃棒能加快固体溶解
B. 操作②为过滤,得到的滤液显酸性
C. 操作③盛放药品的仪器是坩埚
D. 操作④的目的是除去滤渣中的杂质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[化学一选修3:物质结构与性质](15 分)
铀是原子反应堆的原料,常见铀的化合物有UF4、UO2及(NH4)4[UO2(CO3)3等。
回答下列问题:
(1) UF4用Mg或Ca 还原可得金属铀。基态钙原子的核外电子排布式为__________________;熔点:MgO(2852℃)高于CaO(2614℃),原因是_______________________________;金属铀的一种堆积方式为体心立方堆积,该堆积方式的空间利用率为_______________________________。
(2)已知:2UO2+5NH4HF2 ![]() 2UF4·NH4F+3NH3↑+ 4H2O↑,NH4HF2中含有的作用力是________(填选项字母)。
2UF4·NH4F+3NH3↑+ 4H2O↑,NH4HF2中含有的作用力是________(填选项字母)。
a.氢键 b.配位键 c.共价键 d.离子键 e.金属键
(3)已知:3[(NH4)4[UO2(CO3)3] ![]() 3UO2+10NH3 ↑+9CO2 ↑+N2 ↑+9H2O↑
3UO2+10NH3 ↑+9CO2 ↑+N2 ↑+9H2O↑
①NH4+的空间构型为_____________________,与NH4+互为等电子体的分子或离子有_____(任写两种)。
②CO32-中碳原子的杂化轨道类型为___________________________。
③分解产物中属于非极性分子的是____________________(填选项字母)。
a.NH3 b. CO2 C.N2 d. H2O
(4)UO2的晶胞结构及晶胞参数如图所示:
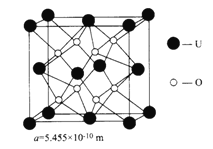
①晶胞中U 的配位数为__________________________。
②UO2晶体的密度为_____________g·cm-3(列出计算式即可。设NA表示阿伏加德罗常数的值)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.链节是高分子化合物中重复出现的结构单元,如聚乙烯的链节是CH2=CH2
B.丙烯和聚丙烯都能使溴水褪色
C.高分子化合物没有固定的熔沸点
D.加聚反应生存环境高分子化合物的同时,还有H2O等小分子物质生成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列描述中正确的是 ( )
A. 纯碱溶于热水后去污效果增强,说明纯碱的水解反应是吸热反应
B. NH3(g) + HCl(g) = NH4Cl(s) 在较低温度下能自发进行,说明该反应的ΔH>0
C. 500℃、30 MPa下,将7 g N2和3 g H2置于密闭容器中充分反应生成NH3(g),放热19.3 kJ,其热化学方程式为N2(g)+3H2(g)![]() 2NH3(g) ΔH=-38.6 kJ·mol-1
2NH3(g) ΔH=-38.6 kJ·mol-1
D. 甲烷的燃烧热(ΔH)为-890.3 kJ·mol-1,则甲烷燃烧的热化学方程式可表示为CH4(g)+2O2(g)= CO2(g)+2H2O(g) ΔH=-890.3 kJ·mol-1
【答案】A
【解析】A. 纯碱溶于热水后去污效果增强,说明升高温度促进了水解,使水解平衡正向移动,所以可以说明纯碱的水解是吸热反应,故A正确;B. 根据△G=△H-T△S可知,当△G小于0时反应自发进行,由于反应NH3(g) + HCl(g) = NH4Cl(s)是熵值减小的反应,所以如果该反应在较低温度下能自发进行,则说明该反应的△H<0,故B错误;C.因合成氨的反应是可逆反应,所以无法确定将7 g N2和3 g H2置于密闭容器中充分反应后,生成了多少NH3(g),故无法计算该反应的焓变,故C错误;D. 燃烧热指的是1mol纯物质完全燃烧生成稳定的氧化物时所放出的能量,所以生成的水应为液态,即甲烷燃烧的热化学方程式应表示为CH4(g)+2O2(g)= CO2(g)+2H2O(l) ΔH=-890.3 kJ·mol-1,故D错误;答案选A。
【题型】单选题
【结束】
14
【题目】在0.1 mol·L-1的CH3COOH溶液中,要抑制醋酸电离,且c(H+)增大,应采取的措施是
A. 加水 B. 升温 C. 加适量CH3COONa固体 D. 通适量HCl气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)现有a.BaCl2 b.金刚石 c.NH4Cl d.Na2SO4 e.干冰 f.碘片六种物质,按下列要求回答(若有多个选项的,多选错选不给分):
①熔化时需要破坏共价键的是______, 熔点最高的是_______,熔点最低的是_______。
②属于离子化合物的是________,只含有离子键的物质是________,含有两种化学键的物质是_________,含有分子间作用力的是__________。
(2)看下图回答下列问题
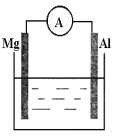
①若烧杯中溶液为稀硫酸,则观察到的现象是___________,负极反应式为___________。
②若烧杯中溶液为氢氧化钠溶液,则负极为_______(填Mg或Al),总反应方程式为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.铁是应用最广泛的金属,铁的卤化物、氯化物以及高价铁的含氧酸盐均为重要化合物。已知氧化铁是一种重要的化工原料,无水氯化铁遇潮湿空气极易吸水生成FeCl3·nH2O。
(1)某学习小组用下图装置在实验室制备无水氯化铁,请你一起参与该小组的活动。
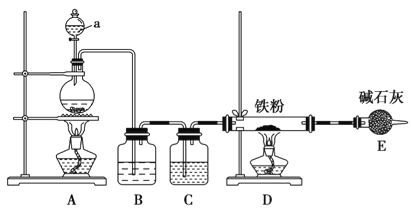
①装置A中发生的离子方程式_______________
②装置B的作用是________,C中的试剂______________。
③实验开始时先点燃___处酒精灯;装置E的作用为__________。
(2)工业上制备无水氯化铁的一种工艺流程如下:
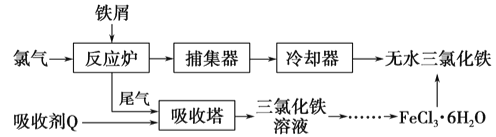
①吸收塔中发生反应的离子方程式为__________
②简述由FeCl3·6H2O晶体得到无水氯化铁的操作:____________
Ⅱ.利用如图所示的装置,可以验证NH3和HCl的有关性质。实验前a、b、c活塞均关闭。
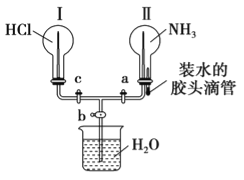
(1)若要在烧瓶Ⅱ中产生“喷泉”现象,烧瓶Ⅰ中不产生“喷泉”现象,其操作方法是______。
(2)若先打开a、c活塞,再挤压胶头滴管(假设NH3不能被完全吸收),在烧瓶Ⅱ中可观察到的现象是_____。
(3)通过挤压胶头滴管和控制活塞的开关,要在烧瓶Ⅰ中产生“喷泉”现象,烧瓶Ⅱ中不产生“喷泉”现象,其操作方法是___________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com