
【题目】利用![]() 溶液、尿素
溶液、尿素![]() 为原料制取水合肼
为原料制取水合肼![]() 的流程如下:
的流程如下:
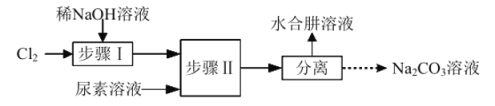
已知:①![]()
②![]() 沸点约
沸点约![]() ,具有强还原性,能与
,具有强还原性,能与![]() 剧烈反应生成
剧烈反应生成![]() 。
。
下列说法错误的是( )
A.步骤Ⅰ、Ⅱ反应过程中需控制好温度
B.所得副产物![]() 可用于工业上吸收
可用于工业上吸收![]() 尾气
尾气
C.步骤Ⅱ具体操作为将尿素溶液逐滴加入![]() 溶液中
溶液中
D.水合肼与![]() 反应的离子方程式为:
反应的离子方程式为:![]() ↑
↑
【答案】C
【解析】
实验流程可知步骤I为氯气和氢氧化钠溶液的反应,生成NaClO,为避免生成NaClO3,应控制温度在40![]() 以下,生成的NaClO与尿素反应生成N2H4H2O和Na2CO3,可用蒸馏的方法分离出N2H4H2O,副产品Na2CO3溶液中通入二氧化硫,可制得Na2SO3。
以下,生成的NaClO与尿素反应生成N2H4H2O和Na2CO3,可用蒸馏的方法分离出N2H4H2O,副产品Na2CO3溶液中通入二氧化硫,可制得Na2SO3。
A. 步骤I制备NaClO溶液时,若温度超过40![]() ,Cl2与NaOH溶液反应生成NaClO3和NaC1,步骤Ⅱ中NaClO碱性溶液与尿素水溶液在40
,Cl2与NaOH溶液反应生成NaClO3和NaC1,步骤Ⅱ中NaClO碱性溶液与尿素水溶液在40![]() 以下反应,所以步骤Ⅰ、Ⅱ反应过程中需控制好温度,A正确;
以下反应,所以步骤Ⅰ、Ⅱ反应过程中需控制好温度,A正确;
B. 副产品Na2CO3溶液中通入二氧化硫,可制得Na2SO3,可以用于吸收![]() 尾气,B正确;
尾气,B正确;
C. 步骤Ⅱ的反应为NaClO碱性溶液与尿素反应制备水合肼,由于水合肼具有强还原性,能与NaClO剧烈反应生成氮气,为了防止水合肼被氧化,应逐滴滴加NaClO碱性溶液,C错误;
D. 水合肼被![]() 氧化生成氮气,其反应的离子方程式为:
氧化生成氮气,其反应的离子方程式为:![]() ↑,D正确;故答案为:C。
↑,D正确;故答案为:C。


科目:高中化学 来源: 题型:
【题目】按要求回答下列问题:
(1)浓度为0.1mol/L醋酸钠溶液中质子守恒表达式为___________;
(2)等浓度的NaHCO3、Na2CO3混合溶液中的物料守恒表达式为____________;
(3) 浓度为0.1mol/LNa2CO3溶液电荷守恒表达式为__________;
(4) 泡沫灭火器灭火时发生反应的离子方程是______________。
(5)常温下,NaHSO3溶液中粒子浓度由大到小的顺序_________。
(6)将pH=8的Ba(OH)2溶液与pH=5的稀盐酸混合,并保持在100 ℃的恒温。欲使混合溶液的pH=7,则Ba(OH)2溶液和盐酸的体积比为________。(已知100℃,KW=1.0×10-12)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.测定盐酸和NaOH溶液反应的中和热时,每次实验均应测量三个温度,即盐酸的起始温度、NaOH溶液的起始温度和反应体系的最高温度
B.HCl和NaOH反应的中和热ΔH=57.3 kJ·mol1,则稀H2SO4和稀Ca(OH)2溶液反应的中和热 ΔH=2×57.3 kJ·mol1
C.燃烧热是指在101 kPa时可燃物完全燃烧时所放出的热量
D.S燃烧热的热化学方程式为S(s)+![]() O2(g)=SO3(g) ΔH=315 kJ·mol-1
O2(g)=SO3(g) ΔH=315 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.室温时,Ka=1×10-5浓度为0.1mol/L的HA溶液,pH=3
B.将pH=2的HCl溶液和pH=4的H2SO4溶液等体积混合,所得溶液pH=3
C.0.1 mol/L氨水和0.1 mol/L NH4Cl溶液等体积混合后所得溶液pH>7,则c(NH4+) < c(NH3·H2O)
D.向0.1 mol/L、pH=1的NaHA溶液中加入NaOH溶液反应的离子方程式为:HA-+ OH- = H2O + A2-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在36 g碳不完全燃烧所得气体中,CO占![]() 体积,CO2占
体积,CO2占![]() 体积。且有:
体积。且有:
C(s)+![]() O2(g)===CO(g) ΔH=-110.5 kJ·mol-1
O2(g)===CO(g) ΔH=-110.5 kJ·mol-1
CO(g)+![]() O2(g)===CO2(g) ΔH=-283 kJ·mol-1
O2(g)===CO2(g) ΔH=-283 kJ·mol-1
与这些碳完全燃烧相比,损失的热量是
A. 172.5 kJ B. 1 149 kJ C. 283 kJ D. 517.5 kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于平衡体系mA(g)+nB(g) ![]() pC(g)+qD(g) ΔH<0。下列结论中错误的是
pC(g)+qD(g) ΔH<0。下列结论中错误的是
A.若温度不变,将容器的体积缩小到原来的一半,此时A的浓度为原来的2.1倍,则m+n<p+q
B.若平衡时,A、B的转化率相等,说明反应开始时,A、B的物质的量之比为m∶n
C.若m+n≠p+q,温度不变时压强增大到原来的2倍,达到新平衡时,总体积一定比原来的![]() 要小
要小
D.若m+n=p+q,则往含有a mol气体的平衡体系中再加入a mol的B,达到新平衡时,气体的总物质的量等于2a
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关水溶液中的平衡相关的问题,请填空
(1)已知常温下,将氯化铝溶液和碳酸钠溶液混合,有白色沉淀产生,写出反应离子方程式______________
(2)体积均为100 mL、pH均为2的CH3COOH与一元酸HX,加水稀释过程中pH与溶液体积的关系如图所示。同浓度,同体积的CH3COONa与NaX溶液,离子总数目: CH3COONa溶液_______NaX溶液(填>,<,=)

(3)电离平衡常数是衡量弱电解质电离程度强弱的物理量。已知:
化学式 | 电离常数(25 ℃) |
HCN | K=4.9×10-10 |
CH3COOH | K=1.8×10-5 |
①25℃时,浓度均为0.01 mol·L-1 HCN和NaCN混合溶液显_____性(填酸,碱,中)。溶液中HCN浓度_________CN-浓度(填>,<,=)
②25 ℃时,在CH3COOH与CH3COONa的混合溶液中,若测得pH=6,则溶液中![]() =____。
=____。
(4)在25°C下,将x mol·L-1的氨水与y mol·L-1的盐酸等体积混合,反应后溶液中显中性,则c(NH4+)____c(Cl-)(填“>” 、“<” 或“=” );用含x和y的代数式表示出氨水的电离平衡常数______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO和NO都是汽车尾气中的有害物质,它们之间能缓慢地发生如下反应:2NO(g)+2CO(g)![]() N2(g)+2CO2(g)
N2(g)+2CO2(g)
ΔH<0,现利用此反应,拟设计一种环保装置,用来消除汽车尾气对大气的污染,下列设计方案可以提高尾气处理效率的是( )
①选用适当的催化剂 ②提高装置温度 ③降低装置的压强 ④装置中放入碱石灰
A. ①③B. ②④
C. ①④D. ②③
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com