
分析 KI溶液和FeCl3溶液发生氧化还原反应生成Fe2+和I2,反应后的溶液中加入CCl4,如有机层呈紫红色,则说明生成碘,如反应存在限度,则反应后溶液中存在本身就少量的Fe3+,可用KSCN溶液检验,以此解答.
解答 解:(3)反应后的溶液中加入CCl4,如有机层呈紫红色,则说明生成碘,故答案为:I2的CCl4溶液;紫红;
(4)向含Fe3+的溶液中滴加几滴KSCN溶液呈血红色,这是Fe3+的特殊反应,所以可滴加KSCN溶液,溶液显血红色,发生Fe3++3SCN-═Fe(SCN)3,就说明Fe3+没有反应完(或KI和FeCl3的反应有一定的限度).
故答案为:⑤;溶液显血红色.
点评 本题考查了铁离子和亚铁离子的检验、探究物质的组成、测量物质的含量,题目难度中等,注意掌握检验铁离子和亚铁离子的方法,把握可逆反应的特征.


 举一反三期末百分冲刺卷系列答案
举一反三期末百分冲刺卷系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | a:b | B. | a:2b | C. | a:(2a+2b) | D. | a:(a+2b) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 热稳定性:H2O>HF>H2S | B. | 原子半径:Na>Mg>O | ||
| C. | 酸性:H3PO4>H2SO4>HClO4 | D. | 离子半径:Cl->S2->K+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③④ | B. | ⑥⑦⑧⑨ | C. | ④⑤ | D. | 全部 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 毒品就是有毒的药品 | |
| B. | 我国明代医学家李时珍所著的医学名著是《本草纲目》 | |
| C. | R表示处方药,OTC表示非处方药 | |
| D. | 麻黄碱是国际奥委会严格禁止使用的兴奋剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  | B. | CH3CH2CH2CH2CH3 | C. | 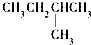 | D. | 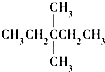 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 由水电离出来的c(H+)=1.0×10-12 mol/L | |
| B. | c(CH3COOH)>c(H+)>c(CH3COO-)>c(OH-) | |
| C. | 与同浓度的盐酸分别加水稀释10倍:pH(醋酸)>pH(盐酸) | |
| D. | 在醋酸溶液中加入少量醋酸钠固体,能抑制醋酸的电离 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
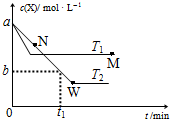 在恒容密闭容器中通入X并发生反应:2X(g)?Y(g),温度T1、T2下X的物质的量浓度c(X)随时间t变化的曲线如图所示,下列叙述正确的是( )
在恒容密闭容器中通入X并发生反应:2X(g)?Y(g),温度T1、T2下X的物质的量浓度c(X)随时间t变化的曲线如图所示,下列叙述正确的是( )| A. | M点的正反应速率v正小于N点的逆反应速率v逆 | |
| B. | T2下,在0~t1时间内,v(Y)=$\frac{a-b}{{t}_{1}}$mol•L--1•min--1 | |
| C. | M点时再加入一定量X,平衡后X的转化率减小 | |
| D. | 该反应进行到M点放出的热量小于进行到W点放出的热量 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com