
【题目】锡及其化合物在生产、生活中有着重要的用途。已知:Sn的熔点为231℃;Sn2+易水解、易被氧化;SnCl4极易水解、熔点为-33 ℃、沸点为114 ℃。请按要求回答下列相关问题:
(1)元素锡比同主族碳的周期数大3,锡的原子序数为_______________。
(2)用于微电子器件生产的锡粉纯度测定:①取1.19 g试样溶于稀硫酸中(杂质不参与反应),使Sn完全转化为Sn2+;②加入过量的Fe2(SO4)3;③用0.1000 mol/L K2Cr2O7溶液滴定(产物中Cr呈+3价),消耗20.00 mL。步骤②中加入Fe2(SO4)3的作用是__________________;此锡粉样品中锡的质量分数_____________。
(3)用于镀锡工业的硫酸亚锡(SnSO4)的制备路线如下:

①步骤Ⅰ加入Sn粉的作用: __________________及调节溶液pH。
②步骤Ⅱ、步骤Ⅴ的操作名称为________________,写出该过程用到的一种玻璃仪器的名称:_______________。
③步骤Ⅲ生成SnO的离子方程式:__________________。
④步骤Ⅴ操作依次为 _____________、____________、过滤、洗涤、低温干燥。
(4)SnCl4蒸气遇氨及水汽呈浓烟状,因而可制作烟幕弹,其反应的化学方程式为__________________。
【答案】(1)50(2)Sn2++2Fe3+=2Fe2++Sn4+;60%
(3)①防止Sn2+被氧化为Sn4+②过滤;漏斗、玻璃棒、烧杯中的任一种
③Sn2++2HCO3-=SnO↓+2CO2↑+H2O④蒸发(或加热)浓缩、冷却(或降温)结晶
(4)SnCl4+4NH3+4H2O=Sn(OH)4+4NH4Cl
【解析】试题分析:(1)元素锡是第IVA的元素,由于比同主族碳的周期数大3,所以锡的原子序数为6+8+18+18=50;
(2)步骤②中加入Fe2(SO4)3的作用是将Sn2+全部氧化为Sn4+;根据氧化还原反应中电子转移数目相等可得关系式:3Sn~3Fe2(SO4)3~K2Cr2O7,n(K2Cr2O7)=0.1000 mol/L×0.02L=2×10-3mol,则n(Sn)=2×10-3mol×3=6×10-3mol,所以此锡粉样品中锡的质量分数是[(6×10-3mol×119g/mol) ÷1.19 g] ×100%=60%;
(3)①步骤ⅠSn与HCl反应产生SnCl2,SnCl2容易被空气中的氧气氧化为Sn4+,加入Sn粉的作用是防止Sn2+被氧化为Sn4+,同时可以调节溶液pH。
②在步骤Ⅱ过滤用到的玻璃仪器有烧杯、漏斗、玻璃棒;
③步骤Ⅲ中向含有Sn2+的溶液中加入HCO3-,发生反应生成SnO,该反应的离子方程式是Sn2++ 2HCO3-=SnO↓+2CO2↑+ H2O;
④SnO与硫酸反应产生SnSO4,从溶液中分离得到该物质的晶体的操作步骤依次为蒸发浓缩、冷却结晶、过滤、洗涤、低温干燥;
(4)SnCl4是强酸弱碱盐,遇水容易发生水解反应产生Sn(OH)4和HCl,HCl和氨发生反应沉淀NH4Cl,产生白烟,因此可制作烟幕弹,其反应的化学方程式为SnCl4+4NH3+4H2O=Sn(OH)4+4NH4Cl。


科目:高中化学 来源: 题型:
【题目】【化学-选修2:化学与技术】印尼火山喷发不仅带来壮观的美景,还给附近的居民带来物质财富,有许多居民冒着生命危险在底部的火山口收集纯硫磺块来赚取丰厚收入。硫磺可用于生产化工原料硫酸。某工厂用如图所示的工艺流程生产硫酸:

请回答下列问题:
(1)为充分利用反应放出的热量,接触室中应安装 (填设备名称).吸收塔中填充有许多瓷管,其作用是 。
(2)为使硫磺充分燃烧,经流量计1通入燃烧室的氧气过量50%,为提高SO2转化率,经流量计2的氧气量为接触室中二氧化硫完全氧化时理论需氧量的2.5倍,则生产过程中流经流量计1和流量计2的空气体积比应为 。假设接触室中SO2的转化率为95%,b管排出的尾气中二氧化硫的体积分数为 (空气中氧气的体积分数按0.2计),该尾气的处理方法是 。
(3)与以硫铁矿为原料的生产工艺相比,该工艺的特点是 (可多选)。
A.耗氧量减少 B.二氧化硫的转化率提高 C.产生的废渣减少 D.不需要使用催化剂
(4)硫酸的用途非常广,可应用于下列哪些方面 。
A.橡胶的硫化 B.表面活性剂“烷基苯磺酸钠”的合成 C.铅蓄电池的生产 D.过磷酸钙的制备
(5)矿物燃料的燃烧是产生大气中SO2的主要原因之一.在燃煤中加入适量的石灰石,可有效减少煤燃烧时SO2的排放,请写出此脱硫过程中反应的化学方程式 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属(M)—空气电池(如图)具有原料易得、能量密度高等优点,有望成为新能源汽车和移动设备的电源。该类电池放电的总反应方程式为:4M+nO2+2nH2O=4M(OH)n。已知:电池的“理论比能量”指单位质量的电极材料理论上能释放出的最大电能。下列说法不正确的是
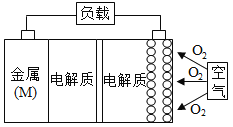
A.采用多孔电极的目的是提高电极与电解质溶液的接触面积,并有利于氧气扩散至电极表面
B.比较Mg、Al、Zn三种金属—空气电池,Al—空气电池的理论比能量最高
C.M—空气电池放电过程的正极反应式:4Mn++nO2+2nH2O+4ne-=4M(OH)n
D.在M—空气电池中,为防止负极区沉积Mg(OH)2,宜采用中性电解质及阳离子交换膜
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电解法制取有广泛用途的Na2FeO4,同时获得氢气。工作原理如图1所示,c( Na2FeO4)随初始c(NaOH)的变化如图2。
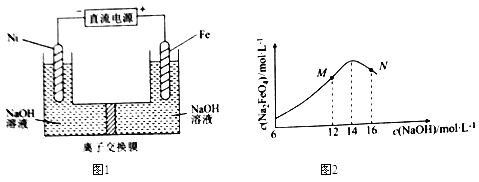
已知:FeO42-为紫红色;Na2FeO4只在强碱性条件下稳定,易被H2还原;溶液中OH-浓度过高,铁电极区会产生红褐色物质。下列说法错误的是( )
A.制备Na2FeO4的电极反应为Fe-6e-+8OH-=FeO42-+4H2O
B.电解过程中,须将阴极产生的气体及时排出
C.MN两点中c(Na2FeO4)低于最高值的原因不同,在M点会有Fe(OH)3生成
D.图1中的离子交换膜为阴离子交换膜,电解过程中,阴极区附近pH会增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与日常生活紧密相关。下列说法中,不正确的是
A.甲醛可作食品防腐剂 B.氢氧化铝可作抗酸药
C.氯化钠可作食品调味剂 D.生石灰可作食品干燥剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是( )
A.干冰、液态氯化氢都是电解质
B.根据是否具有丁达尔效应,将分散系分为溶液、浊液和胶体
C. NaOH晶体中既含有离子键又含有共价键
D.Na2O、Fe2O3、Al2O3既属于碱性氧化物,又属于离子化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,CH4与H2O(g)发生反应:CH4(g)+H2O(g)![]() CO(g)+3H2(g)。设起始
CO(g)+3H2(g)。设起始![]() =Z,在恒压下,平衡时
=Z,在恒压下,平衡时![]() (CH4)的体积分数与Z和T(温度)的关系如图所示。下列说法正确的是
(CH4)的体积分数与Z和T(温度)的关系如图所示。下列说法正确的是
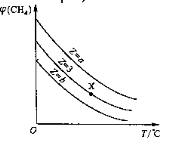
A.该反应的焓变ΔH<0
B.图中Z的大小为b>3>a
C.图中X点对应的平衡混合物中![]() =3
=3
D.温度不变时,图中X点对应的平衡在加压后![]() (CH4)减小
(CH4)减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用下图所示装置制取乙酸乙酯,请回答以下问题。
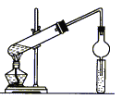
(1)导气管连接球形干燥管插入Na2CO3溶液中,除了冷凝作用外,另一个重要作 ;
(2)浓H2SO4的作用是 ;
(3)饱和Na2CO3溶液的作用除了降低乙酸乙酯的溶解度和除去乙醇外,还有_____________;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将TiO2转化为TiCl4是工业冶炼金属钛的主要反应之一。已知:
TiO2(s)+2Cl2(g)===TiCl4(l)+O2(g) ΔH=+140.5 kJ·mol-1
C(s,石墨)+O2(g)===CO(g) ΔH=-110.5 kJ·mol-1
则反应TiO2(s)+2Cl2(g)+2C(s,石墨)===TiCl4(l)+2CO(g)的ΔH是
A.-80.5 kJ·mol-1 B.+30.0 kJ·mol-1
C.-30.0 kJ·mol-1 D.+80.5 kJ·mol-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com