
下列说法正确的是
A.反应CaCO3(s)=CaO(s)+CO2(g)在常温下不能发生,则该反应的△H>0
B.0.1 mol·L-1CH3COOH溶液加水稀释后,溶液中 的值减小
的值减小
C.铅蓄电池在放电过程中,负极质量增加,正极质量减少
D.锅炉中沉积的CaSO4可用饱和Na2CO3溶液浸泡,再将不溶物用稀盐酸溶解除去
科目:高中化学 来源: 题型:
常温下设a代表Ba(OH)2,b代表NaOH溶液,c代表NH3·H2O溶液。下列说法正确的是
A.同物质的量浓度的三种溶液的pH:a>b>c
B.同pH时,三种溶液稀释相同倍数后的pH:a<b<c
C.同pH、同体积的三种溶液消耗同浓度盐酸的体积:a=b=c
D.同pH时,稀释不同倍数后pH仍相同,三种溶液稀释的倍数:a>b>c
查看答案和解析>>
科目:高中化学 来源: 题型:
下列事实不能用于判断元素金属性强弱的是( )
A.1 mol金属单质在反应中失去电子的多少
B.金属单质之间发生的置换反应
C.金属元素最高价氧化物对应的水化物的碱性强弱
D.金属元素的单质与水或酸置换出氢气的难易程度
查看答案和解析>>
科目:高中化学 来源: 题型:
铝热反应常用于冶炼高熔点的金属, 可简单认为是铝与某些金属氧化物在高温条件下发生的反应。某学习小组对铝热反应(以Al和Fe2O3反应为例)实验进行研究。
查阅数据得到Al、Al2O3、Fe、Fe2O3的熔点、沸点数据如下表所示:
| 物质 | Al | Al2O3 | Fe | Fe2O3 |
| 熔点/℃ | 660 | 2054 | 1535 | 1565 |
| 沸点/℃ | 2467 | 2980 | 2750 | ┄ |
试回答下列问题:
(1)在铝热反应中金属铝表现出 性(填“氧化”或“还原”)。请判断下列金属中那一个不能由铝热反应制取 。(填序号)
①Fe ②Cr(铬) ③V(钒) ④Ca ⑤Mn
(2)某同学推测,铝热反应所得到的熔融物中应含有铁、铝两种金属。如设计一个简单的实验方案证明该熔融物中含有金属铝,则实验所需用的试剂为 ,可观察到的实验现象是 。
(3)另一同学推测铝热反应得到的熔融物中还含有Fe2O3,他设计了如下方案来验证:
取一块该熔融物投入到少量稀硫酸中,向反应后的混合液中滴加物质甲的溶液,观察溶液颜色未变血红色,即可证明熔融物中不含有Fe2O3。则
①物质甲是 (填化学式)。
②该同学的实验方案是否合理? (填“合理”或“不合理”)。
理由:
查看答案和解析>>
科目:高中化学 来源: 题型:
下列物质的转化在给定条件下能实现的是
①NaAlO2(aq) AlCl3
AlCl3 Al ② NH3
Al ② NH3 NO
NO HNO3
HNO3
③NaCl(饱和)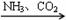 NaHCO3
NaHCO3 Na2CO3 ④FeS2
Na2CO3 ④FeS2 SO3
SO3 H2SO4
H2SO4
A.②③ B.①④ C.②④ D.③④
查看答案和解析>>
科目:高中化学 来源: 题型:
为探索工业废料的再利用,某化学兴趣小组设计了如下实验流程,用含有铝、铁和铜的合金废料制取氯化铝、绿矾晶体(FeSO4·7H2O)和胆矾晶体。

请回答:
(1)写出步骤Ⅰ反应的离子方程式: ▲ 。
(2)试剂X是 ▲ 。步骤Ⅰ、Ⅱ、Ⅲ中均需进行的实验操作是 ▲ 。
 (3)进行步骤Ⅱ时,该小组用如图7所示装置及试剂制取CO2并将制得的气体通入溶液A中。一段时间后,观察到烧杯中产生的白色沉淀会逐渐减少。为了避免固体C减少,可采取的改进措施是 ▲ 。
(3)进行步骤Ⅱ时,该小组用如图7所示装置及试剂制取CO2并将制得的气体通入溶液A中。一段时间后,观察到烧杯中产生的白色沉淀会逐渐减少。为了避免固体C减少,可采取的改进措施是 ▲ 。
(4)用固体F制备CuSO4溶液,可设计以下三种途径:

写出途径①中反应的离子方程式 ▲ ,请选出你认为的最佳途径并说明选择的理由 ▲ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列离子方程式中,属于水解反应的是( )
A.CH3COOH + H2O  CH3COO- + H3O+ B.CO2 + H2O
CH3COO- + H3O+ B.CO2 + H2O  HCO3- + H+
HCO3- + H+
C.F- + H2O  HF + OH- D.HS-+ H2O
HF + OH- D.HS-+ H2O  S2- + H3O+
S2- + H3O+
查看答案和解析>>
科目:高中化学 来源: 题型:
将pH=1的盐酸平均分成2份,1份加适量水,另1份加入与该盐酸物质的量浓度相同的适量NaOH溶液后,pH都升高了1,则加入的水与NaOH溶液的体积比为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【化学—选修3:物质结构与性质】(15分)乙炔是有机合成工业的一种原料。工业上曾用CaC2与水反应生成乙炔。 (1) CaC2与水反应生成乙炔的反应方程式为________.
(2)比较第二周期元素C、N、O三种元素的第一电离能从大到小顺序为 ______(用元素符号表示),用原子结构观点加以解释______。
 (3)CaC中C22-与O22+互为等电子体,O22+的电子式可表示为______;1molO22+中含有的Π键数目为_______。
(3)CaC中C22-与O22+互为等电子体,O22+的电子式可表示为______;1molO22+中含有的Π键数目为_______。
(4)CaC2晶体的晶胞结构与NaCI晶体的相似(如右图所示),但CaC2
晶体中含有的中哑铃形C22-的存在,使晶胞沿一个方向拉长。CaC2晶体
中1个Ca2+周围距离最近的C22-数目为______。
(5)将乙炔通入[Cu(NH3)2]Cl溶液生成Cu2C2红棕色沉淀。Cu+基
态核外电子排布式为 _______。
(6)乙炔与氢氰酸反应可得丙烯腈(H2C

 =CH-C≡N)。丙烯腈分子中碳原子轨道杂化类型是______;分子中处于同一直线上的原子数目最多为______。
=CH-C≡N)。丙烯腈分子中碳原子轨道杂化类型是______;分子中处于同一直线上的原子数目最多为______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com