
����Ŀ���״����е㣺64.7oC����һ�������Դ����ȡ�״��ij���ķ����кܶ࣬����CO2��H2�״��Ƽ״��ķ�Ӧ����ʽ���£�
CO2��g��+3H2��g��CH3OH��g��+H2O��g����H=��49.4kJ/mol
��һ�������£����ݻ�Ϊ2L�����ܱ������г���1.2mol CO2��g����2.8mol H2��g�����ڲ�ͬ�¶��´�ƽ��ʱ��CH3OH����������仯������ͼ1��ʾ��
��1������T1�����£��ӿ�ʼ��ƽ������ʱ��Ϊ10���ӣ��ⶨƽ��ʱ������ѹǿΪP1MPa��
�ٿ�ʼ��ƽ���ƽ����Ӧ����v��CO2��=mol/��Lmin��
�ڸ��¶��·�Ӧ��ƽ�ⳣ��K=
��2��ʹ������Ӧ��T2��T1��T2���ĺ����½��в���ƽ�⣮�ⶨ��ƽ��������Ϊt2���ӣ�ƽ��ʱ������ѹǿΪP2 MPa����t210��P2P1���������=��
��ij�о�С��ͨ��ʵ��̽����ͬ����̼��[n��H2��/n��CO2��]�Է�Ӧ��ת���ʵ�Ӱ�죮
���ݻ�Ϊ2L�ĺ��º����ܱ��������������ʵ���Ϊ4mol��H2 ��g����CO2 ��g���Բ�ͬ����̼��[n��H2��/n��CO2��]��ʼ���з�Ӧ���ֱ�ﵽƽ��ʱ���ⶨʣ��CH3OH��Ũ���Լ���CO2��g����H2��g����ת���ʣ�
��3��ͼ2������CO2��g��ת���ʵı仯���ߣ�����ͼ�л���H2��g����ת���ʵı仯���ߣ���AΪ��㣩��������Ӧ�ı�ע ��
����������CO2��H2Ҳ������ȡ��һ����Ҫ���л��ܼ�����CH3OCH3 ��
��֪2CH3OH��g��=CH3OCH3��g��+H2O��g����H=��25��kJ/molд������CO2��H2��ȡ���ѵ��Ȼ�ѧ����ʽ ��
���𰸡�
��1��0.04��100��mol/L����2
��2��������
��3�� ��2CO2��g��+6H2��g��=CH3OCH3��g��+3H2O��g����H=��123.8kJ/mol
��2CO2��g��+6H2��g��=CH3OCH3��g��+3H2O��g����H=��123.8kJ/mol
���������⣺��1��һ�������£����ݻ�Ϊ2L�����ܱ������г���1.2mol CO2��g����2.8mol H2��g�����ڲ�ͬ�¶��´�ƽ��ʱ������T1�����£��ӿ�ʼ��ƽ������ʱ��Ϊ10���ӣ�CH3OH���������Ϊ33.3%��Ϊ ![]() ���跴Ӧ�Ķ�����̼���ʵ���Ũ��Ϊx��
���跴Ӧ�Ķ�����̼���ʵ���Ũ��Ϊx��
CO2��g��+ | 3H2��g�� | CH3OH��g��+ | H2O��g�� | |
��ʼ����mol/L�� | 0.6 | 1.4 | 0 | 0 |
�仯����mol/L�� | X | 3x | X | X |
ƽ������mol/L�� | 0.6-x | 1.4-3x | x | X |
![]() =
= ![]()
x=0.4mol/L�ٿ�ʼ��ƽ���ƽ����Ӧ����v��CO2��= ![]() =0.04mol/��Lmin�������Դ��ǣ�0.04���ڸ��¶��·�Ӧ��ƽ�ⳣ��K=
=0.04mol/��Lmin�������Դ��ǣ�0.04���ڸ��¶��·�Ӧ��ƽ�ⳣ��K= ![]() =100��mol/L����2 �� ���Դ��ǣ�100��mol/L����2����2������T1�����£��ӿ�ʼ��ƽ������ʱ��Ϊ10���ӣ��ⶨƽ��ʱ������ѹǿΪP1MPa��ʹ������Ӧ��T2��T1��T2���ĺ����½��в���ƽ�⣮�ⶨ��ƽ��������Ϊt2���ӣ�ƽ��ʱ������ѹǿΪP2 MPa���¶����߷�Ӧ�������ﵽƽ������ʱ�����̣�t2��10����ӦΪ���ȷ�Ӧ������ƽ����������������ʵ�����������ѹǿ����
=100��mol/L����2 �� ���Դ��ǣ�100��mol/L����2����2������T1�����£��ӿ�ʼ��ƽ������ʱ��Ϊ10���ӣ��ⶨƽ��ʱ������ѹǿΪP1MPa��ʹ������Ӧ��T2��T1��T2���ĺ����½��в���ƽ�⣮�ⶨ��ƽ��������Ϊt2���ӣ�ƽ��ʱ������ѹǿΪP2 MPa���¶����߷�Ӧ�������ﵽƽ������ʱ�����̣�t2��10����ӦΪ���ȷ�Ӧ������ƽ����������������ʵ�����������ѹǿ����
P2��P1 ��
���Դ��ǣ�����������3��CO2��g��+3H2��g��CH3OH��g��+H2O��g����H=��49.4kJ/mol����Ӧ�����Բ�ͬ����̼�� ![]() ��Ӧ������ֵԽ������̼��ת����Խ������ת���ʼ�С����ֵΪ3ʱ�ͷ�Ӧ����ͬ������ת������ͬ���ݴ˻�������ת���ʱ仯����Ϊ��
��Ӧ������ֵԽ������̼��ת����Խ������ת���ʼ�С����ֵΪ3ʱ�ͷ�Ӧ����ͬ������ת������ͬ���ݴ˻�������ת���ʱ仯����Ϊ��
���Դ��ǣ�  ��
��
����֪��2CH3OH��g��=CH3OCH3��g��+H2O��g����H=��25��kJ/mol����CO2��g��+3H2��g��CH3OH��g��+H2O��g����H=��49.4kJ/mol
��˹���ɼ���õ����ڡ�2+�ٵõ���2CO2��g��+6H2��g��=CH3OCH3��g��+3H2O��g����H=��123.8 kJ/mol
���Դ��ǣ�2CO2��g��+6H2��g��=CH3OCH3��g��+3H2O��g����H=��123.8 kJ/mol��


 ������ϰ�ο����뵥Ԫ���ϵ�д�
������ϰ�ο����뵥Ԫ���ϵ�д� �����Ծ���ĩ���100��ϵ�д�
�����Ծ���ĩ���100��ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ʷ���ȫ����ȷ����
�� | �� | �� | ���������� | |
A | ���� | ���� | �ռ� | �������� |
B | �ռ� | ���� | ʳ�� | һ����̼ |
C | ������ | ���� | ʯ��ʯ | ˮ |
D | ���Լ� | ̼�� | �մ� | �������� |
A. A B. B C. C D. D
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ӦmA(g)+nB(g)![]() pC(g)��һ���¶ȺͲ�ͬѹǿ�´ﵽƽ��ʱ���ֱ�õ�A�����ʵ���Ũ�����±���ʾ��
pC(g)��һ���¶ȺͲ�ͬѹǿ�´ﵽƽ��ʱ���ֱ�õ�A�����ʵ���Ũ�����±���ʾ��
ѹǿ/Pa | 2��105 | 5��105 | 1��106 |
c(A)/(mol��L-1) | 0.08 | 0.20 | 0.44 |
�����������ݣ��ش�
(1)��ѹǿ��2��105 Pa���ӵ�5��105 Paʱ��ƽ�� (��������ҡ�����)�ƶ��������� ��
(2)��ѹǿ��5��105 Pa���ӵ�1��106 Paʱ���÷�Ӧ�Ļ�ѧƽ�� �ƶ����жϵ������� �����ܵ�ԭ���� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����NA��ʾ�����ӵ�����������������ȷ����
A����״���£�22.4 L��������NA�����ʷ���
B�����³�ѹ�£�0.1 mol Na2CO3���е�Na+��ĿΪ0.2NA
C����״���£�22.4 L H2O���еķ�����Ϊ NA
D�����ʵ���Ũ��Ϊ0.5 mol��L1��MgCl2��Һ�У�����Cl����ΪNA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ�������£���3 mol N2��3 mol H2����һ���ݻ��̶����ܱ������У�������Ӧ��N2(g)+3H2(g)![]() 2NH3(g)������Ӧ�ﵽƽ��ʱNH3Ϊn mol������������ȫ��ͬ�������У������¶Ȳ��䣬��ƽ��ʱNH3��Ϊn mol������������в���ȷ����
2NH3(g)������Ӧ�ﵽƽ��ʱNH3Ϊn mol������������ȫ��ͬ�������У������¶Ȳ��䣬��ƽ��ʱNH3��Ϊn mol������������в���ȷ����
ѡ�� | ��ʼ״̬/mol | ||
N2 | H2 | NH3 | |
A | 2 | 0 | 2 |
B | 2.5 | 1.5 | 1 |
C |
| 2 |
|
D | 0 | 0 | 2 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��689 Kʱ����1 L�ܱ������н��еķ�Ӧ��H2(g)��I2(g)![]() 2HI(g)�ﵽƽ�⣬ͼ�ױ�ʾ����ʼ��Ϊ1 mol��L��1 H2��1 mol��L��1 I2ʱ�������ڸ����ʵ�Ũ��c�ı仯��ʱ��t�Ĺ�ϵʾ��ͼ��
2HI(g)�ﵽƽ�⣬ͼ�ױ�ʾ����ʼ��Ϊ1 mol��L��1 H2��1 mol��L��1 I2ʱ�������ڸ����ʵ�Ũ��c�ı仯��ʱ��t�Ĺ�ϵʾ��ͼ��
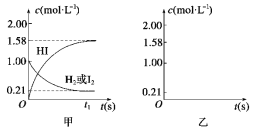
(1)����ͼ���л�������ʼ��Ϊ2 mol��L��1 HIʱ�������и����ʵ�Ũ�ȱ仯��ʱ��Ĺ�ϵʾ��ͼ��
(2)��ͼ�е���ʵ˵����ѧƽ����е�������_____________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������ʵ��Ӧ�Ļ�ѧ���ﲻ��ȷ���ǣ� ��
A.���ȵĴ�����Һ������ϴ���ۣ�CO32��+H2O?HCO3��+OH��
B.����FeSO4��Һʱ�������������ۣ�Fe3++Fe�T2Fe2+
C.��NH4HSO4��Һ�мӹ�����NaOH��Һ�����ȣ�NH4++H++2OH�� ![]() NH3��+2H2O
NH3��+2H2O
D.��Ƭ���ڽ�Ũ��NaOH��Һ�У��������壺2Al+2OH��+2H2O�T2AlO2��+3H2��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���Ҷ���HSCH2CH2SH����һ��������ˮ�ľ�ϸ������Ʒ���۵㩁41�棬�е� 144�棬���������ԣ�ʵ�����������1��2����������Ϊԭ����ȡ�Ҷ����Ƶĺϳ�·�����£� 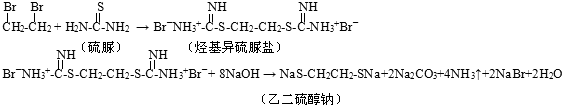
�Ʊ�װ����ͼ1��ʾ�����Ⱥͼг�װ�����ԣ���
�ش��� �����⣺
��1��ȡ��������������ƿ�У������Ҵ��������ܽ⣬�ټ���1��2���������飮һ��ʱ����������������������������ܵ����� �� ʹ������a��������ͨ��Һ©�����ŵ��� ��
��2�����ˣ��õ������������ξ��壮����Һ�л����Ҵ��IJ����� �� ����������ƣ�
��3����ʹ��ͼ1��װ�ã��������������ξ��������NaOH��Һ����1.5Сʱ����ȴ���ټ���ϡH2SO4���ɵ��Ҷ��� �ټ���ϡH2SO4�����Ҷ��Ļ�ѧ����ʽΪ ��
�ڴӷ�Ӧ��Ļ�����з����Ҷ��IJ����� �� ����������ƣ�
��ʹ�ø�װ����һ������ȱ�ݣ��Ľ��Ĵ�ʩ�� ��
��4�������ϣ���ȡ9.4g�Ҷ���M=94gmol��1����ͬʱ�����Ƶ�NaBrg��
��5��NaBr��Na2SO4���ܽ�����¶ȵı仯��ͼ2��ʾ�������ӷ�Һ����ȡNa2SO4�ķ����� ��
��6�����ʵ��֤���Ҷ����к���̼Ԫ�أ� �� 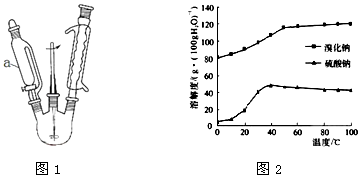
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵����ȷ����
A. Ħ���ǽ�һ����Ŀ��ԭ�ӡ����ӻ���ӵ���������ɳ���������ϵ������һ��������
B. ���ʵ����ȱ�ʾ���ʵ������ֱ�ʾ���ʵ�����
C. �����ӵ�������12 kg 12C�к��е�̼ԭ����Ŀ
D. 1 mol H2O���10 mol����
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com