
【题目】碲化钠(Na2Te)可用作有机合成试剂及缩合反应中的催化剂。以碲铅矿(主要成分为PbTe)和粗盐(含CaCl2、MgCl2及一些硫酸盐、泥沙)为原料制备碲化钠的工艺流程如下:
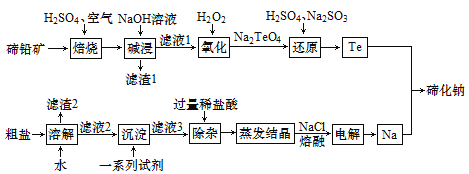
回答下列问题:
(1)Na2TeO4中Te的化合价为___。
(2)“沉淀”步骤中一系列试剂均过量,这些试剂依次包括_____(填化学式)和NaOH。
(3)“蒸发结晶”时用到的主要仪器有铁架台(带铁圈)、酒精灯、坩埚钳、_____等。
(4)已知“焙烧”后,碲主要以TeO2形式存在,“焙烧”反应的化学方程式为____。
(5)依据“氧化”“还原”两步反应可判知Na2TeO4、H2O2和Na2SO4氧化性由强到弱的顺序为___;“还原”步骤中,还原剂与氧化剂的物质的量比为_______。
(6)若制得8.7kg碲化钠,理论上电解产生标准状况下氯气的体积为______升。
【答案】+6 BaCl2、Na2CO3 蒸发皿、玻璃棒 2PbTe+3O2+2H2SO4![]() 2PbSO4+2TeO2+2H2O H2O2>Na2TeO4>Na2SO4 3:1 1120
2PbSO4+2TeO2+2H2O H2O2>Na2TeO4>Na2SO4 3:1 1120
【解析】
(1)根据化合物中所有元素化合价代数和等于0确定Te的化合价;
(2)根据粗盐中含有的杂质确定使用的沉淀试剂;
(3)根据蒸发结晶操作判断使用的仪器;
(4)“焙烧”后,碲铅矿(主要成分为PbTe)中的碲主要以TeO2形式存在,根据电子守恒、原子守恒书写反应方程式;
(5)根据氧化性:氧化剂>氧化产物比较氧化性,根据氧化还原反应的规律计算“还原”步骤中,还原剂与氧化剂的物质的量比;
(6)先计算Na2Te的物质的量,确定需要Na的物质的量,然后利用NaCl制取Na与Cl2的关系得到Cl2的物质的量,最后根据V=n·Vm计算氯气的体积。
(1)在Na2TeO4中,Na是+1价,O是-2价,由于化合物中所有元素化合价代数和等于0所以Te的化合价为+6价;
(2)在粗盐NaCl中含有杂质为Na2SO4、CaCl2、MgCl2,除去Na2SO4使用BaCl2溶液,除去CaCl2使用Na2CO3溶液,除去MgCl2使用NaOH溶液,为了将杂质除尽,加入的除杂试剂要过量,而且要容易除去,所以BaCl2溶液要在Na2CO3溶液之前使用,使原溶液中的Ca2+及加入Ba2+都转化为难溶性的碳酸盐一起除去。所以“沉淀”步骤中一系列试剂均过量,这些试剂依次包括BaCl2、Na2CO3和NaOH。
(3) 在“蒸发结晶”时用到的主要仪器有铁架台(带铁圈)、酒精灯、坩埚钳、蒸发皿、玻璃棒等。
(4) “焙烧”时碲铅矿(主要成分为PbTe)中的碲主要以TeO2形式存在,结合流程图,并根据电子守恒、原子守恒可得该反应的化学方程式:2PbTe+3O2+2H2SO4![]() 2PbSO4+2TeO2+2H2O;
2PbSO4+2TeO2+2H2O;
(5)根据流程图可知H2O2将TeO2氧化为Na2TeO4,Na2TeO4将Na2SO3氧化为Na2SO4.根据氧化还原反应的规律:氧化剂的氧化性大于氧化产物的氧化性,可知物质的氧化性有强到弱的顺序为:H2O2>Na2TeO4>Na2SO4;在还原反应中发生反应:Na2TeO4+3Na2SO3+H2SO4=Te+4Na2SO4+H2O;反应中还原剂是Na2SO3,氧化剂是Na2TeO4,二者的物质的量的比是3:1;
(6) 8.7kg碲化钠的物质的量是n(Na2Te)=8700g÷174g/mol=50mol,根据Na元素守恒可知需要Na的物质的量是50mol×2=100mol,根据方程式2NaCl(熔融)![]() 2Na+Cl2↑可知产生100molNa,会同时得到50molCl2,其在标准状况下的体积V(Cl2)= 50mol×22.4L/mol=1120L。
2Na+Cl2↑可知产生100molNa,会同时得到50molCl2,其在标准状况下的体积V(Cl2)= 50mol×22.4L/mol=1120L。


科目:高中化学 来源: 题型:
【题目】实验室用密度为1.25g·mL-1,质量分数36.5%的浓盐酸配制0.1mol·L-1的盐酸240mL,请回答下列问题:
(1)浓盐酸的物质的量浓度为_______。
(2)配制240 mL0.1mol·L-1的盐酸应选用_______mL的容量瓶,需要量取浓盐酸体积为_______mL。
(3)定容时,除了烧杯、玻璃棒、容量瓶外,还需要的玻璃仪器是_______。
(4)正确的操作顺序是________(填序号)
①用胶头滴管逐滴加水,使溶液凹液面恰好与容量瓶刻度线相切
②向容量瓶中加水至液面接近瓶颈上的刻度线1-2cm处
③根据计算,用量筒称取一定体积的浓盐酸
④将容量瓶盖紧,振荡,摇匀
⑤将浓盐酸倒入烧杯中加水稀释,并不断用玻璃棒搅拌,静置待其冷却
⑥将溶液用玻璃棒引流注入查漏过的容量瓶中
⑦少量水洗涤烧杯及玻璃棒2至3次,并将每次的洗涤液也注入容量瓶中
(5)下列操作对所配溶液的浓度大小有何影响 (填“偏大”、“偏小”或“无影响”)。
①定容时,俯视刻度线,浓度_________;
②定容摇匀后发现溶液凹面低于刻度线,加水至刻度线,浓度________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将m克Fe2O3、Al2O3样品溶解在过量的200mL0.1mol·L-1的硫酸溶液中,然后向其中加入NaOH溶液使Fe3+、Al3+刚好完全沉淀,用去NaOH溶液100mL,则NaOH溶液的浓度为( )
A.0.1mol·L-1B.0.2mol·L-1C.0.4mol·L-1D.0.8mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应的离子方程式书写正确的是( )
A.实验室用浓盐酸与MnO2反应制Cl2:MnO2+2H++2Cl-![]() Cl2↑+Mn2++H2O
Cl2↑+Mn2++H2O
B.稀硫酸与NaOH溶液反应:2H++2OH-=2H2O
C.醋酸洗涤铜器表面的碱式碳酸铜:Cu2(OH) 2CO3+4H+=2Cu2++CO2↑+3H2O
D.向沸腾的蒸馏水中滴加饱和FeCl3溶液制备Fe(OH)3胶体:Fe3++3H2O![]() Fe(OH) 3(胶体)+3H+
Fe(OH) 3(胶体)+3H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸四氨合铜晶体{[Cu(NH3)4]SO4·H2O}为深蓝色晶体,溶于水,不溶于乙醇,主要用作印染剂、杀虫剂及制备某些含铜的化合物。某实验小组拟制备氨气,并通入到硫酸铜溶液中制备硫酸四氨合铜,装置如下:
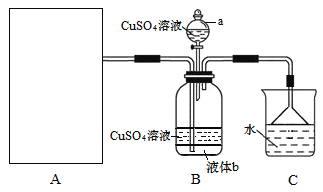
回答下列问题:
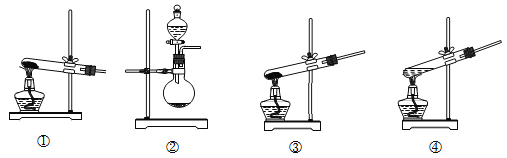
(1)装置A为制备氨气的实验装置,下列装置中可选用的有______(填标号)。
(2)装置a的名称为______;已知液体b与CuSO4溶液互不相溶,是常用的有机溶剂,则液体b的化学式为_____,作用是______。
(3)由于硫酸四氨合铜晶体能在热水中分解,实验时可向所得溶液中加入______来获得晶体。
(4)硫酸四氨合铜晶体中铜含量的测定可用碘量法。在微酸性溶液中(pH=3~4),Cu2+与过量I-作用,生成I2和CuI(不溶于水也不溶于非氧化性酸),生成的I2用Na2S2O3标准溶液滴定(已知滴定反应为:I2+2S2O32-=S4O62-+2I-)。
①滴定过程中使用的指示剂为______,滴定终点的现象为______。
②准确称取1.00g产品,配制成100mL溶液。取20mL该溶液,用0.050mol/LNa2S2O3标准溶液进行滴定,消耗标准溶液16.00mL,计算产品纯度为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用如图所示装置进行下列实验,能得出相应实验结论的是( )
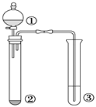
选项 | ① | ② | ③ | 实验结论 |
A | 浓盐酸 | KMnO4 | 紫色石蕊试液 | 氯气具有酸性、漂白性 |
B | 浓硫酸 | 蔗糖 | 溴水 | 浓硫酸具有脱水性、氧化性 |
C | 稀盐酸 | Na2SO3 | Ba(NO3)2溶液 | SO2与可溶性钡盐均可以生成白色沉淀 |
D | 浓硝酸 | Na2CO3 | Na2SiO3溶液 | 非金属性:N>C>Si |
A. AB. BC. CD. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】草酸晶体(H2C2O4·2H2O)无色,熔点为101℃,易溶于水,受热脱水、升华,170℃以上分解。某学生拟用下图装置做草酸晶体的分解实验并验证部分产物,下列说法错误的是
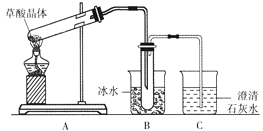
A. 装置A中的大试管口应略向下倾斜,是因为加热草酸晶体时会产生水
B. 装置B的主要作用是冷凝(水蒸气、草酸)等,防止草酸进入装置C中,干扰CO2的检验
C. 装置C中可观察到的现象是有气泡冒出,澄清石灰水变浑浊
D. 本实验能证明草酸晶体的分解产物有二氧化碳
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硝酰硫酸(NOSO4H)主要用于染料、医药等工业。实验室用如图装置(夹持装置略)制取少量的NOSO4H,并检验产品纯度。已知:NOSO4H遇水水解,但溶于浓硫酸而不分解。

(1)利用装置A制取SO2,下列最适宜的试剂是_____(填下列字母编号)
A.Na2SO3固体和20%硝酸 B.Na2SO3固体和20%硫酸
C.Na2SO3固体和70%硫酸 D.Na2SO3固体和18.4mol/L硫酸
(2)装置B中浓HNO3和SO2在浓H2SO4作用下反应制得NOSO4H。
①为了控制通入SO2的速率,可以采取的措施是_______。
②该反应必须维持体系温度不低于20℃。若温度过高,产率降低的可能原因是____。
③开始反应缓慢,待生成少量NOSO4H后,温度变化不大,但反应速率明显加快,其原因可能是______。
(3)在实验装置存在可能导致NOSO4H产量降低的缺陷是______。
(4)测定NOSO4H的纯度
准确称取1.337 g产品加入250 mL碘量瓶中,加入0.1000mol/L、60.00 mL的KMnO4标准溶液和10 mL 25%H2SO4溶液,然后摇匀。用0.2500 mol/L草酸钠标准溶液滴定,消耗草酸钠溶液的体积为20.00 mL。
已知:2KMnO4+5NOSO4H+2H2O=K2SO4+2MnSO4+5HNO3+2H2SO4
①配平:__MnO4-+___C2O42-+______=___Mn2++____+__H2O
②亚硝酰硫酸的纯度=___%(计算结果保留两位有效数字)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】取软锰矿石(主要成分为MnO2)116g 跟足量浓盐酸发生如下反应(杂质不参与反应)MnO2+4HCl(浓) ![]() MnCl2+Cl2↑+2H2O,制得22.4L Cl2(标准状况)。下列有关说法中不正确的是
MnCl2+Cl2↑+2H2O,制得22.4L Cl2(标准状况)。下列有关说法中不正确的是
A.这种软锰矿石中MnO2的质量分数为75%
B.被氧化的HCl的物质的量为4mol
C.参加反应的HCl的质量为146g
D.被还原的MnO2的物质的量为1mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com