
| A. | 3.5 mol/L | B. | 4.5 mol/L | C. | 7.0 mol/L | D. | 9.0 mol/L |
分析 把7.2g纯铁粉投入到40mL某HNO3溶液中,充分反应后剩余固体1.6g,说明生成硝酸亚铁,硝酸完全反应,反应中硝酸起氧化剂、酸性作用,起酸性作用的酸性生成硝酸亚铁,根据Fe元素守恒计算硝酸亚铁,起氧化剂作用的硝酸生成NO和NO2,根据N元素守恒可知n(HNO3)=2n[Fe(NO3)2]+n(NO+NO2),最后根据c=$\frac{n}{V}$计算出原HNO3溶液的物质的量浓度.
解答 解:把7.2g纯铁粉投入到40mL某HNO3溶液中,充分反应后剩余固体1.6g,说明生成硝酸亚铁,硝酸完全反应,
参加反应的Fe的质量为:m(Fe)=7.2g-1.6g=5.6g,其物质的量为:n(Fe)=$\frac{5.6g}{56g/mol}$=0.1mol,则生成硝酸亚铁的物质的量为:n[Fe(NO3)2]=n(Fe)=0.1mol,
反应中硝酸起氧化剂、酸性作用,起酸性作用的酸性生成硝酸亚铁,起氧化剂作用的硝酸生成NO和NO2,根据N元素守恒可知该硝酸溶液中含有硝酸的总物质的量为:n(HNO3)=2n[Fe(NO3)2]+n(NO+NO2)=0.1mol×2+0.08mol=0.28mol,
所以原HNO3溶液的物质的量浓度为:c(HNO3)=$\frac{0.28mol}{0.04L}$=7.0mol/L,
故选C.
点评 本题考查氧化还原反应计算,题目难度中等,明确发生反应的实质为解答关键,注意从N元素守恒的角度解答该题,试题培养了学生的分析能力及化学计算能力.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:实验题
| 实验 | 试剂 | 现象 | |
| 滴管 | 试管 | ||
 | 0.2 mol•L-1 Na2SO3溶液 | 饱和Ag2SO4溶液 | Ⅰ.产生白色沉淀 |
| 0.2 mol•L-1 CuSO4 | Ⅱ.溶液变绿,继续滴加产生棕黄色沉淀 | ||
| 0.1 mol•L-1 Al2(SO4)3溶液 | Ⅲ.开始无明显变化,继续滴加产生白色沉淀 | ||

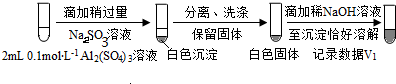
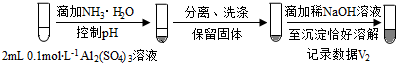 (按图形式呈现).
(按图形式呈现).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 通入过量Cl2:Fe2+、H+、NH4+、Cl-、SO42- | |
| B. | 加入过量NaClO溶液:NH4+、Fe2+、H+、SO42-、ClO- | |
| C. | 加入过量NaOH溶液:Na+、Fe2+、NH4+、SO42-、OH- | |
| D. | 加入过量NaClO溶液和NaOH的混合溶液:Na+、SO42-、Cl-、ClO-、OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 苏打溶液与稀盐酸混合:HCO3-+H+═CO2↑+H2O | |
| B. | NH4HCO3溶液与Ba(OH)2溶液:NH4++HCO3-+Ba2++2OH-═NH3•H2O+BaCO3↓+H2O | |
| C. | 向澄清石灰水中通入过量CO2:OH-+CO2═HCO3- | |
| D. | FeBr2溶液中通入氯气:2Fe2++2Br-+2Cl2═2Fe3++Br2+4Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硒(Se)化氢比硫化氢稳定 | B. | 钫(Fr)与水反应比钾与水反应剧烈 | ||
| C. | 铍(Be)的原子失电子能力比镁弱 | D. | 氢氧化锶(Sr)比氢氧化钙的碱性强 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
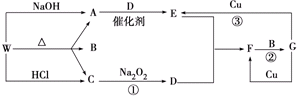
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH3CHO | B. | CH3CH2CHO | C. | CH3COCH3 | D. | CH3CH2CH2CHO |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
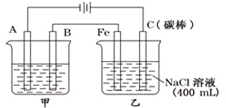 如图为相互串联的甲乙两电解池.
如图为相互串联的甲乙两电解池.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com