
|
在密闭的容器中进行下列反应:M(g)+N(g)
| |
| [ ] | |
A. |
正反应为吸热反应,L为气体 |
B. |
正反应为吸热反应,L为固体 |
C. |
正反应为放热反应,L为液体 |
D. |
正反应为放热反应,L为气体 |
 同步轻松练习系列答案
同步轻松练习系列答案 课课通课程标准思维方法与能力训练系列答案
课课通课程标准思维方法与能力训练系列答案科目:高中化学 来源: 题型:
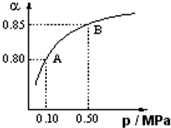 硫酸生产中,SO2催化氧化生成SO3:2SO2(g)+O2(g)
硫酸生产中,SO2催化氧化生成SO3:2SO2(g)+O2(g)| 催化剂 | △ |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| 时间/S | c(CO2)mol/L | c(H2)mol/L |
| 0 | 1.00×10-1 | 3.00×10-1 |
| 1 | 8.50×10-2 | 2.55×10-1 |
| 2 | 6.50×10-2 | 1.95×10-1 |
| 3 | 5.50×10-2 | 1.65×10-1 |
| 4 | 5.00×10-2 | 1.50×10-1 |
| 5 | 5.00×10-2 | 1.50×10-1 |
查看答案和解析>>
科目:高中化学 来源:高二化学(中学生学科素质训练与检测丛书) 题型:013
某温度下,在密闭的容器中进行![]() 的催化氧化.若起始浓度[
的催化氧化.若起始浓度[![]() ]=[
]=[![]() ]=6
mol/L,平衡时测得[
]=6
mol/L,平衡时测得[![]() ]=4.5
mol/L,则下列叙述中不正确的是
]=4.5
mol/L,则下列叙述中不正确的是
[ ]
A.![]() 的转化率为60%
的转化率为60%
B.![]() 的产率为60%
的产率为60%
C.平衡时总压强与起始压强之比为7∶8
D.平衡时V(![]() )∶V(
)∶V(![]() )∶V(
)∶V(![]() )=3∶3∶1
)=3∶3∶1
查看答案和解析>>
科目:高中化学 来源: 题型:013
某温度下,在密闭的容器中进行![]() 的催化氧化.若起始浓度[
的催化氧化.若起始浓度[![]() ]=[
]=[![]() ]=6
mol/L,平衡时测得[
]=6
mol/L,平衡时测得[![]() ]=4.5
mol/L,则下列叙述中不正确的是
]=4.5
mol/L,则下列叙述中不正确的是
[ ]
A.![]() 的转化率为60%
的转化率为60%
B.![]() 的产率为60%
的产率为60%
C.平衡时总压强与起始压强之比为7∶8
D.平衡时V(![]() )∶V(
)∶V(![]() )∶V(
)∶V(![]() )=3∶3∶1
)=3∶3∶1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com