
【题目】甲醇是制造燃料电池的重要原料,工业上用CH4和H2O为原料来制备甲醇。
(1)将2.0 molCH4和3.0molH2O(g)通入反应室(容积为100L),在一定条件下发生反应:CH4(g)+H2O(g)=CO(g)+3H2(g),CH4的平衡转化率与温度、压强的关系如下图。
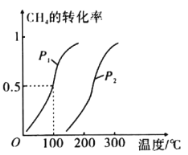
①已知压强为p1,100℃时达到平衡所需的时间为5min,则用H2表示的平均反应速率为_________。
②图中的p1_______ p2(填“<”“>”或“=”),100℃时平衡常数为_______________。
③在其他条件不变的情况下降低温度,重新达到平衡时H2体积分数将________________(填“增大”“减小”或“不变”)
(2)在压强为0.1MPa条件下,将 amolCO与2 amolH2的混合气体在催化剂作用下能自发反应合成甲醇:CO(g)+2H2(g)![]() CH3OH(g)
CH3OH(g)
①该反应的△H________0,△S_________0(填“<”“>”或“=”)
②若容器容积不变,下列措施可提高H2转化率的是__________。
A.升高温度 B.将CH3OH(g)从体系中分离
C.再充入2 molCO和2molH2 D.充入He,使体系总压强增大
【答案】 0.0060mol·L-1·min-1 < 1.35×10-3 减小 < < BC
【解析】(1)①由图可知,100°C时达到平衡时甲烷的转化率为0.5,则转化的甲烷为0.5mol,求出△c(CH4),根据v=![]() ,计算v(CH4),利用速率之比等于化学计量数之比计算v(H2);②根据定一议二原则,定温度同,再比较压强,即作垂直x轴的辅助线,比较平衡时甲烷的转化率,由此判断;平衡常数k=计算出平衡时各组分的浓度,代入平衡常数表达式计算;
,计算v(CH4),利用速率之比等于化学计量数之比计算v(H2);②根据定一议二原则,定温度同,再比较压强,即作垂直x轴的辅助线,比较平衡时甲烷的转化率,由此判断;平衡常数k=计算出平衡时各组分的浓度,代入平衡常数表达式计算;
③降低温度,平衡右移.
(2)混合气体在催化剂作用下能自发反应生成甲醇,而正反应是气体物质的量减小的反应,则说明正反应是放热反应,据此解答。
(1)①由图可知, 100°C时达到平衡时甲烷的转化率为0.5,则转化的甲烷为0.5mol,速率之比等于化学计量数之比,则v(H2)=3v(CH4)=3×![]() =0.0060molL1min1
=0.0060molL1min1
②正反应为气体体积增大的反应,恒温条件下增大压强,化学平衡逆向移动,甲烷的转化率减小,所以P1<P2,
100℃时 CH4(g)+H2O(g)=CO(g)+3H2(g)
初始浓度:0.02 0.03 00
变化浓度:0.01 0.01 0.01 0.03
平衡浓度:0.01 0.02 0.010.03
100℃时平衡常数k=![]() =1.35×10-3 molL2
=1.35×10-3 molL2
③由图像可知,当温度越高时甲烷的转化率越大,说明该反应是吸热反应,降低温度平衡左移,重新达到平衡时H2体积分数将减小.答案为:①0.0060mol·L-1·min-1②<③1.35×10-3
(2)①混合气体在催化剂作用下能自发反应生成甲醇,则说明正反应是放热反应,所以△H<0;正反应是气体物质的量减小的反应,气体的物质的量越多,其熵越大,所以△S<0;②A.升高温度平衡左移,H2转化率减小,A错误;B.将CH3OH(g)从体系中分离出来,平衡右移H2转化率增大,B正确;C.再充入2molCO和2molH2,CO增大的程度大于H2增大的程度,平衡右移,H2转化率增大,C正确;D. 充入He,使体系总压强增大,容器容积不变,反应混合物各组分浓度不变,平衡不移动,H2的转化率不变,D错误;答案选BC;答案为:①<、<②BC


科目:高中化学 来源: 题型:
【题目】A、B、C、D、E、F、G、L、I九种主族元素分布在三个不同的短周期,它们的原子序数依次增大,其中B、C、D为同一周期,A与E、B与G、D与L分别为同一主族,C、D、F三种元素的原子序数之和为28,F的质子数比D多5,D的最外层电子数是F最外层电子数的2倍。C和D的最外层电子数之和为11。请回答下列问题:
(1)以上非金属元素中所形成的最简单气态氢化物稳定性最弱的是(填化学式)______,E、F、L所形成的简单离子的半径由小到大的顺序为(用离子符号表示)_____。
(2)由L、I两元素可按原子个数比1∶1组成化合物X,化合物X中各原子均满足8电子的稳定结构,则X的电子式为____。
(3)少量固体化合物E2D2投入到化合物E2L的水溶液中,只观察到有淡黄色沉淀产生,并无气泡冒出,请结合信息写出该反应的离子方程式 _____________________________。
(4)由A、B、C、D按原子个数比4∶1∶1∶2形成一种化合物Y,则Y的化学式为_______
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知草酸晶体(H2C2O4·2H2O)的熔点为101℃,170℃分解。下列选用的装置和药品能达到实验目的的是
A | B | C | D |
|
|
|
|
制取SO2 | 制取NO2 | H2C2O4·2H2O分解 | 分离苯与溴苯 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法或有关化学用语的表达正确的是
A. 1s电子云呈球形,表示电子绕原子核做圆周运动
B. 钠原子由1s22s22p63p1→ls22s22p63p1时,原子释放能量,由基态转化成激发态
C. 因氧元素的电负性比氮元素的大,故氧原子的第一电离能比氮原子的大
D. 基态Fe原子的外围电子排布图为
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物的结构简式如图所示,下列关于该有机物的性质说法正确的是
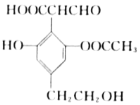
A. 可与银氨溶液反应,不与FeCl3溶液反应显色
B. 可以与H2反应,Imol该物质最多消耗5molH2
C. 1mol该物质与足量金属Na反应,最多产生2molH2
D. 1mol物质与NaOH溶液反应,最多消耗4 molNaOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用化石燃料开采、加工过程产生的H2S 废气制取氢气,既价廉又环保。
(1)工业上可用组成为K2O·M2O3·2RO2·nH2O的无机材料纯化制取的氢气。
①已知元素M、R均位于元素周期表中第3周期,两种元素原子的质子数之和为27,则R的原子结构示意图为____________;
②常温下,不能与M单质发生反应的是____________(填序号);
a.CuSO4溶液 b.Fe2O3 c.浓硫酸 d.NaOH溶液 e.Na2CO3固体
(2)利用H2S废气制取氢气的方法有多种。
①高温热分解法已知:H2S(g)![]() H2(g)+1/2S2(g)
H2(g)+1/2S2(g)
在恒容密闭容器中,控制不同温度进行H2S分解实验。以H2S起始浓度均为c mol·L-1测定H2S的转化率,结果见图。曲线a为H2S的平衡转化率与温度关系曲线,b曲线表示不同温度下反应经过相同时间且未达到化学平衡时H2S的转化率。根据图像回答下列问题:

i 计算 985 ℃时H2S按上述反应分解的平衡常数 K=________;
ii 说明随温度的升高,曲线b向曲线a逼近的原因:________________________________;
②电化学法

i该法制氢过程如图。反应池中反应物的流向采用气、液逆流方式,其目的是____________;
ii反应池中发生反应的化学方程式为____________;
iii反应后的溶液进入电解池,电解总反应的离子方程式为_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是
A.需要加热的反应不一定是吸热反应
B.反应物的总能量高于生成物的总能量,发生放热反应
C.一个氯分子(Cl﹣Cl)变成2个Cl原子时会放出能量
D.生石灰投入水中的反应是放热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学习小组依据SO2具有还原性,推测SO2能被Cl2氧化生成SO2Cl2。
查阅资料:SO2Cl2的熔点为-54.1 ℃,沸点为69.1 ℃,极易水解,遇潮湿空气会产生白雾。
(1)化合物SO2Cl2中S元素的化合价是__________。
(2)实验室中制备氯气时为得到干燥纯净的氯气,应将气体依次通过盛有_______和_______的洗气瓶。
(3)用如图所示装置制备SO2Cl2。

①B中冷凝水从__________ (填“m”或“n”)口进入。
②C中的药品是______。目的一是吸收外界空气中的水蒸气,目的二是:_______________。
③向A所得液体中加水,出现白雾,振荡、静置得到无色溶液。经检验该溶液中的阴离子(除OH-外)只有SO42-、Cl-,写出SO2Cl2与H2O反应的化学方程式:_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E为原子序数依次增大的五种短周期主族元素,其中仅含有一种金属元素,A单质试自然界中密度最小的气体,A和D最外层电子数相同;B、C和E在周期表中相邻,且C、E同主族.B、C的最外层电子数之和等于D的原子核外电子数,A和C可形成A2C和A2C2两种常见的液态化合物.请回答下列问题:
(1)A元素的名称是____,D在周期表中的位置______.E的离子结构示意图___.
(2)B2分子的电子式:__,A2C的结构式:______.
(3)用电子式表示D2E化合物的形成过程为__.
(4)用含A元素最简单的有机化合物与赤热的氧化铜反应生成一种单质、液态氧化物和一可以使澄清石灰水变浑浊的气体,其化学方程式为_______.
(5)在100mL 18mol/L E的最高价氧化物对应水化物的溶液中加入过量的铜片,加热使之充分反应,铜片部分溶解.产生的气体在标准状况下的体积可能是____(填序号)
a.7.32L b.6.72L c.20.16L d.30.24L.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com