
 期末100分闯关海淀考王系列答案
期末100分闯关海淀考王系列答案 小学能力测试卷系列答案
小学能力测试卷系列答案科目:高中化学 来源: 题型:
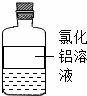
根据图示信息,用化学用语填空:
(1)写出氯化铝中金属元素的元素符号 ;
(2)写出溶液中大量存在的阴离子的符号 ;
(3)标出溶剂中氧元素的化合价 ;
(4)写出氯化铝的化学式 .
查看答案和解析>>
科目:高中化学 来源: 题型:
在0.lmol/L的HA溶液中存在如下电离平衡: HA A-+H+,对于该溶液,下列叙述正确的是
A-+H+,对于该溶液,下列叙述正确的是
A.滴加少量0.lmol/L HCl溶液,平衡向逆反应方向移动,溶液中c(H+)减少
B.加水,溶液中所有离子浓度均减小
C.加入少量NaA固体,平衡向逆反应方向移动,溶液中c(OH-)增大
D.加入少量NaOH固体,平衡向正反应方向移动, 溶液中c(H+)增大
查看答案和解析>>
科目:高中化学 来源: 题型:
常温下,0.1 mol/L某一元酸(HA)溶液中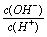 =1×10-8,下列叙述正确的是
=1×10-8,下列叙述正确的是
A.溶液中水电离出的c(H+)=10-10 mol/L
B.溶液中c(H+)+c(A-)=0.1 mol/L
C.溶液中加入一定量CH3COONa晶体或加水稀释,溶液的c(OH-)均增大
D.与0.05mol/L NaOH溶液等体积混合后所得溶液中离子浓度大小关系为
c(A-)>c(Na+)>c(OH-)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是 ( )
①正常雨水的PH为7.0,酸雨的PH小于7.0。
②严格执行机动车尾气排放标准有利于防止大气污染
③使用二氧化硫和某些含硫化合物进行增白的食品会对人体健康产生损害
④使用氯气对自来水消毒过程中,生成的有机氯化物可能对人体有害
⑤食品厂产生的含丰富氮、磷营养素的废水可长期排向水库养鱼
A、①②③ B、①④⑤ C、②③④ D、③④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于乙烯和聚乙烯的叙述不正确的是 ( )
A.乙烯常温下是气体,为纯净物;聚乙烯常温下是固体,为混合物
B.乙烯的化学性质比聚乙烯活泼
C.取等质量的乙烯和聚乙烯完全燃烧后,生成的CO2和H2O的质量分别相等
D.取等物质的量的乙烯和聚乙烯完全燃烧后,生成的CO2和H2O的物质的量分别相等
查看答案和解析>>
科目:高中化学 来源: 题型:
把A、B、C、D四块金属泡在稀H2SO4中,用导线两两相连可以组成各种原电池。若A、B相连,A为负极;C、D相连,D上有气泡逸出;A、C相连A极减轻;B、D相连,B为正极。则四种金属的活泼性顺序由大到小排列为( )
A. A>C>D>B B. A>C>B>D C. B>D>C>A D. A>B>C>D
查看答案和解析>>
科目:高中化学 来源: 题型:
未来新能源的特点是资源丰富,在使用时对环境无污染或污染很小,且可以再生。下列属于未来新能源标准的的是 ( )
①天然气 ②煤 ③核能 ④石油 ⑤太阳能 ⑥生物质能 ⑦风能 ⑧氢能
A.①②③④ B.③④⑤⑥⑦⑧ C.③⑤⑥⑦⑧ D.⑤⑥⑦⑧
查看答案和解析>>
科目:高中化学 来源: 题型:
CO2和CH4是两种重要的温室气体,通过CH4和CO2反应制造更高价值化学品是目前的研究目标。
(1)250℃时,以镍合金为催化剂,向4 L容器中通入6 mol CO2、6 mol CH4,发生如下反应:CO2 (g)+CH4(g) 2CO(g)+2H2(g)。平衡体系中各组分体积分数如下表:
2CO(g)+2H2(g)。平衡体系中各组分体积分数如下表:
| 物质 | CH4 | CO2 | CO | H2 |
| 体积分数 | 0.1 | 0.1 | 0.4 | 0.4 |
①此温度下该反应的平衡常数K=__________
②已知:CH4(g)+2O2(g)=CO2(g)+2H2O(g) △H=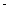 890.3 kJ·mol-1
890.3 kJ·mol-1
CO(g)+H2O (g)=CO2(g)+H2 (g) △H=+2.8 kJ·mol-1
2CO(g)+O2(g)=2CO2(g) △H=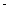 566.0 kJ·mol-1
566.0 kJ·mol-1
 反应CO2(g)+CH4(g)
反应CO2(g)+CH4(g) 2CO(g)+2H2(g) 的△H=________________
2CO(g)+2H2(g) 的△H=________________
(2)以二氧化钛表面覆盖Cu2Al2O4为催化剂,可以将CO2和CH4直接转化成乙酸。
①在不同温度下催化剂的催化效率与乙酸的生成速率如右图所示。250~300℃时,温度升高而乙酸的生成速率降低的原因是_____________________
②为了提高该反应中CH4的转化率,可以采取的措施是________________________
③将Cu2Al2O4溶解在稀硝酸中的离子方程式为___________________________
(3)Li2O、Na2O、MgO均能吸收CO2。①如果寻找吸收CO2的其他物质,下列建议合理的是______
a.可在碱性氧化物中寻找
b.可在ⅠA、ⅡA族元素形成的氧化物中寻找
c.可在具有强氧化性的物质中寻找
②Li2O吸收CO2后,产物用于合成Li4SiO4,Li4SiO4用于吸收、释放CO2。原理是:在500℃,CO2与Li4SiO4接触后生成Li2CO3;平衡后加热至700℃,反应逆向进行,放出CO2,Li4SiO4再生,说明该原理的化学方程式是___________________________
(4)利用反应A可将释放的CO2转化为具有工业利用价值的产品。
反应A:
高温电解技术能高效实现(3)中反应A,工作原理示意图如下:
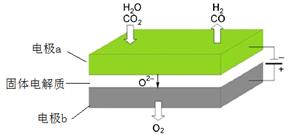
CO2在电极a放电的反应式是_____________________________________________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com