
| A元素原子的核外p电子总数比s电子总数少1 |
| B元素原子p电子总数与s电子总数相等,且不与A元素在同一周期 |
| C原子所有轨道全满或半满 |
| D元素的主族序数与周期数的差为4 |
| E是前四周期中电负性最小的元素 |
| F在周期表的第七列 |
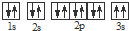 ,违背了
,违背了

科目:高中化学 来源: 题型:
| A、溶液中SO42-的浓度是0.3 mol/L |
| B、溶液中一定含有A13+和NH4+ |
| C、一定不存在Mg2+,可能存在A13+ |
| D、一定存在Cl- 可能含CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:
 如图是学校实验室从化学试剂商店买回的硫酸试剂标签上的部分内容,据此,回答问题:
如图是学校实验室从化学试剂商店买回的硫酸试剂标签上的部分内容,据此,回答问题:查看答案和解析>>
科目:高中化学 来源: 题型:
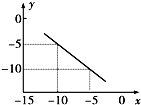 (1)25℃时,将pH=11的NaOH溶液与pH=4的硫酸溶液混合,若所得混合溶液pH=9,则NaOH溶液与硫酸溶液的体积比为
(1)25℃时,将pH=11的NaOH溶液与pH=4的硫酸溶液混合,若所得混合溶液pH=9,则NaOH溶液与硫酸溶液的体积比为查看答案和解析>>
科目:高中化学 来源: 题型:
| A、酸性:H2SiO3>H2CO3 |
| B、碱性:Mg(OH)2>Al(OH)3 |
| C、稳定性:SiH4>PH3 |
| D、原子半径:N>C |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、c(H+)和c(OH-)的乘积 | ||||
B、
| ||||
C、
| ||||
| D、pH值 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 电解硫酸钠溶液联合生产硫酸和烧碱溶液的装置如图所示,其中阴极和阳极均为惰性电极.测得同温同压下,气体甲与气体乙的体积比约为1:2,以下说法正确的是( )
电解硫酸钠溶液联合生产硫酸和烧碱溶液的装置如图所示,其中阴极和阳极均为惰性电极.测得同温同压下,气体甲与气体乙的体积比约为1:2,以下说法正确的是( )| A、a极与电源的负极相连 |
| B、产物丙为硫酸溶液 |
| C、离子交换膜d为阳离子交换膜(允许阳离子通过) |
| D、a电极反应式为2H2O+2e-═2OH-+H2↑ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com