
向Ba(OH)2溶液中逐滴加入稀硫酸.请完成下列问题:
(1)写出反应的离子方程式___________________________
(2)下列三种情况下,离子方程式与(1)相同的是________(填序号).
A.向NaHSO4溶液中,逐滴加入Ba(OH)2溶液至溶液显中性
B.向NaHSO4溶液中,逐滴加入Ba(OH)2溶液至SO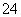 恰好完全沉淀
恰好完全沉淀
C.向NaHSO4溶液中,逐滴加入Ba(OH)2溶液至过量
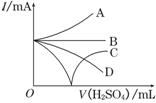
(3)若缓缓加入稀H2SO4直至过量,整个过程中混合溶液中的导电能力(用电流强度I表示)可近似地用右图中的曲线表示是________(填序号).
(4)若向装有Ba(OH)2溶液烧杯里缓缓滴入KAl(SO4)2溶液至Ba2+恰好完全反应.则反应的离子方程式是 _________________________________.
【知识点】离子方程式、元素化合物B1C5
【答案解析】(1)Ba2++2OH-+2H++SO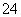 ===BaSO4↓+2H2O (2)A (3)C
===BaSO4↓+2H2O (2)A (3)C
(4) 2Ba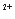 +4OH
+4OH +Al
+Al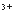 +2SO
+2SO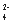 =2BaSO
=2BaSO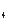 ↓ + AlO
↓ + AlO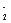 +2H
+2H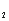 O
O
解析:⑴Ba(OH)2溶液中逐滴加入稀硫酸生成水和硫酸钡沉淀,离子反应为Ba2++2OH-+2H++SO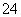 ===BaSO4↓+2H2O
===BaSO4↓+2H2O
⑵A的离子反应分别是Ba2++2OH-+2H++SO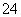 ===BaSO4↓+2H2O,B、C的离子反应是Ba2++OH-+H++SO
===BaSO4↓+2H2O,B、C的离子反应是Ba2++OH-+H++SO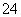 ===BaSO4↓+H2O,选A。
===BaSO4↓+H2O,选A。
⑶随着H2SO4的加入至二者刚好反应时,溶液的导电能力逐渐减弱至不导电,随后硫酸过量,溶液的导电能力逐渐增强,选C。
⑷若向装有Ba(OH)2溶液烧杯里缓缓滴入KAl(SO4)2溶液至Ba2+恰好完全反应,此时二者物质的量比为2:1,则OH-与Al3+的物质的量比为4:1,Al3+全部变为AlO2-,即
2Ba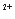 +4OH
+4OH +Al
+Al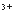 +2SO
+2SO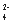 =2BaSO
=2BaSO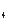 ↓ + AlO
↓ + AlO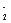 +2H
+2H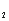 O。
O。
【思路点拨】本题⑷的离子方程式的书写可采取目标法:1molBa2+恰好完全反应,则需KAl(SO4)20.5mol,而OH-与Al3+的物质的量比则为4:1,Al3+全部变为AlO2-。


 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案科目:高中化学 来源: 题型:
进行一氯取代反应后,只能生成三种沸点不同的产物的烷烃是( )
A.(CH3)2CHCH2CH2CH3
B.(CH3CH2)2CHCH3
C.(CH3)2CHCH(CH3)2
D.(CH3)3CCH2CH3
查看答案和解析>>
科目:高中化学 来源: 题型:
化合物A含硫(每个分子只含一个硫原子)、氧以及一种或几种卤素;少量A与水反应可完全水解而不被氧化或还原,所有反应产物均可溶于水;将A配成水溶液稀释后分成几份,分别加入一系列的试剂,现象如下:
①加入硝酸和硝酸银,产生白色沉淀;
②加入氯化钡溶液,无沉淀生成;
③溶液经酸化后加入高锰酸钾溶液,紫色褪去,再加入硝酸钡溶液,产生白色沉淀;
(1)由此判断组成该化合物的元素中,可能存在的卤素有____________,A与水反应后生成的溶液中含有的离子可能有_________________________。
(2)要确定该化合物的分子式,称取11.90g A溶于水稀释至250.0mL,取25.00mL溶液加入足量的高锰酸钾溶液和硝酸钡溶液,使沉淀完全,沉淀经洗涤、干燥后称重,为2.33g,试确定A的化学式,写出计算过程。
查看答案和解析>>
科目:高中化学 来源: 题型:
次氯酸钠(NaClO)和藏氯酸钠(NaClO)都是重要的含氯消毒剂。
(l) NaClO2中,氯元素的化合价为________。
(2)某同学在实验室探究并制作一种家用环保型消毒液(NaClO)发生器,设计了如图的装置,用石墨作电极电解饱和氯化钠溶液。
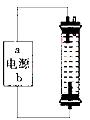
①通电时,为使Cl2被完全吸收,制得有较强杀菌能力的消毒液,则电源有b电极名称为_________(填“正”、“负”、“阴”或“阳”)投。
②装置中发生反应的有关化学方程式为________; 充分电解后溶液中各离子浓度由大到小顺序为____________。
③请说出使用该装置生产消毒液的一个优点和一个注意事项____ 。
(3)化学课外活动小组为测定某品牌“84消毒液”中NaClO的含量(单位体积溶液含有 NaCIO的质量),做了如下实验。已知:
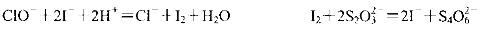
取10 mL该消毒液于锥形瓶中,迅速加入适量的硫酸酸化的碘化钾溶液,密封、充分
混合,暗处放置几分钟。然后加入几滴淀粉溶液,用c mol/L的硫代硫酸钠(Na2S2O3)
标准溶液滴定,平均用去VmL硫代硫酸钠溶液。则该“84消毒液”中NaCIO的含量
为_________g/mL(用含c、V的式子表示)。
(4)以下是过氧化氢法生产亚氯酸钠的工艺流程图:
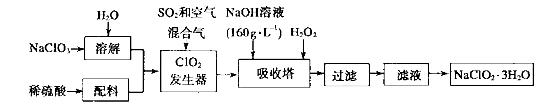
己知:(i)NaClO2 的溶解度随温度升高而增大,适当条件下可结晶析出: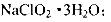
(ii)纯ClO2易分解爆炸,一般用稀有气体或空气稀释到10%以下较安全;
(iii) HClO2可看成是强酸。
①发生器中发生反应的离子方程式为___________________在发生器中鼓入空气的作用可能是__________________。
②吸收塔内的反应的化学方程式为__________________。在吸收塔中为防止被还原成NaCI,所用还原剂的还原性应适中。除外,还可以选择的还原剂_________(填序号)。
A.Na2O2 B.Na2S C.FeCl2
③从滤液中得到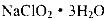 粗晶体的实验操作依次是_________(填序号)。
粗晶体的实验操作依次是_________(填序号)。
A.蒸馏 B.蒸发 C.灼烧 D.过滤 E.冷却结晶
查看答案和解析>>
科目:高中化学 来源: 题型:
能正确表示下列反应的离子方程式是:
A.Cl2通入NaOH溶液中:Cl2+OH-=Cl-+ClO-+H2O
B.NaHCO3溶液中加入HCl:CO32-+2H+=CO2↑+H2O
C.AlCl3溶液中加入过量稀氨水:Al3++4NH3·H2O=AlO2-+4NH4++2H2O
D.Cu溶液于稀HNO3:3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
水溶液X中只可能溶有K+、Mg2+、Al3+、AlO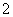 、SiO
、SiO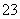 、SO
、SO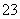 、CO
、CO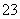 、SO
、SO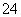 中的若干种离子。某同学对该溶液进行了如图实验:
中的若干种离子。某同学对该溶液进行了如图实验:
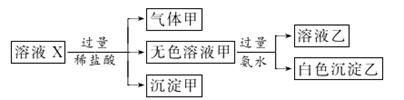
下列判断正确的是( )
A.气体甲一定是纯净物
B.沉淀甲是硅酸和硅酸镁的混合物
C.K+、AlO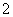 和SiO
和SiO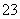 一定存在于溶液X中
一定存在于溶液X中
D.CO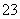 和SO
和SO 一定不存在于溶液X中
一定不存在于溶液X中
查看答案和解析>>
科目:高中化学 来源: 题型:
新型纳米材料氧缺位铁酸盐(MFe2Ox,3<x<4,M=Mn、Zn、Ni且均显+2价,下同)由铁酸盐(MFe2O4)经高温还原而得。常温下,它能使工业废气中的酸性氧化物分解除去。转化流程如图所示:
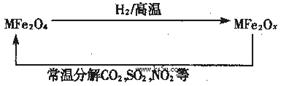
(1)已知铁酸盐(MFe2O4)被H2高温还原时,发生反应的MFe2O4与H2的物质的量之比为 2︰1,则还原产物 MFe2Ox 中x=______,MFe2Ox 中+2价铁与+3价铁的量之比为_____。
(2)在酸性溶液中,Fe2O42-易转化为Fe2+:Fe2O42-+2e-+8H+→2Fe2++4H2O有 KMnO4、Na2CO3、Cu2O、Fe2(SO4)3 四种物质中的一种能使上述还原过程发生,写出该氧化还原反应的离子方程式并配平_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
某气态不饱和烃对氢气的相对密度为27,取0.54 g该烃恰好与浓度为0.2 mol·L-1的溴水100 mL完全反应,使溴水完全褪色。则该烃的分子式为( )
A.C4H6 B.C4H8
C.C4H10 D.不能确定
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com