
 甲醇合成反应为:CO(g)+2H2(g)△CH3OH(g).
甲醇合成反应为:CO(g)+2H2(g)△CH3OH(g).| 10min | 20min | 30min | 40min | 50min | 60min | ||
| 3000C | 0.40 | 0.60 | 0.75 | 0.84 | 0.90 | 0.90 | |
| 5000C | 0.60 | 0.75 | 0.78 | 0.80 | 0.80 | 0.80 |
| △c |
| △t |
| 1 |
| 2 |
| 0.4mol/L |
| 10min |
| 0.8 |
| 0.2×0.42 |
| 1 |
| 2 |
| 0.8mol×2 |
| 2mol |


科目:高中化学 来源: 题型:
A、Na+的基态电子排布图是: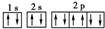 |
B、H2O分子的电子式为: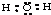 |
| C、Ca2+离子基态电子排布式为:1s22s22p63s23p6 |
D、氯原子结构示意图为: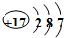 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
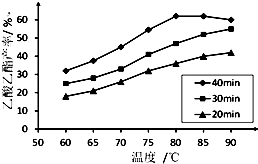 工业上常利用醋酸和乙醇合成有机溶剂乙酸乙酯:
工业上常利用醋酸和乙醇合成有机溶剂乙酸乙酯:| 浓硫酸 |
| △ |
查看答案和解析>>
科目:高中化学 来源: 题型:
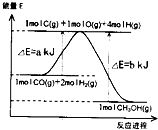
| A、-162 kJ?mol-1 |
| B、+81 kJ?mol-1 |
| C、+162 kJ?mol-1 |
| D、-81 kJ?mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
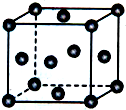 已知X、Y、Z为短周期元素,X、Y同周期,X和Z同主族,Y原子基态时2p轨道上的未成对电子数最多,X的低价氧化物和Y单质分子的电子数相等.W2+的核外电子排布简式为[Ar]3d9.
已知X、Y、Z为短周期元素,X、Y同周期,X和Z同主族,Y原子基态时2p轨道上的未成对电子数最多,X的低价氧化物和Y单质分子的电子数相等.W2+的核外电子排布简式为[Ar]3d9.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com