


 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案科目:高中化学 来源: 题型:
| 实验步骤 | 实现现象 |
| (1)取少量该溶液,加几滴甲基橙 | 溶液变红色 |
| (2)取少量该溶液加热浓缩,加Cu片和浓H2SO4,加热 | 有无色气体产生,气体遇空气中以变成红棕色 |
| (3)取少量该溶液,加BaCl2溶液 | 有白色沉淀生成 |
| (4)取(3)中上层清液,加AgNO3溶液 | 有稳定的白色沉淀生成,且不溶于HNO3 |
| (5)取少量该溶液,加NaOH溶液 | 有白色沉淀生成,当NaOH过量时沉淀部分溶解 |
查看答案和解析>>
科目:高中化学 来源: 题型:
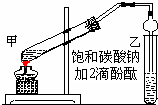 实验室制取乙酸乙酯的主要步骤如图:
实验室制取乙酸乙酯的主要步骤如图:查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
| CO | H2O | H2 | CO | |||
| 1 | 650 | 4 | 2 | 1.6 | 2.4 | 6 |
| 2 | 900 | 2 | 1 | 0.4 | 1.6 | 3 |
| 3 | 900 | a | b | c | d | t |
| a |
| b |
| 放电 |
| 充电 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 元素代号 | I1 | I2 | I3 | I4 |
| X | 2080 | 4000 | 6100 | 9400 |
| Y | 500 | 4600 | 6900 | 9500 |
| Z | 740 | 1500 | 7700 | 10500 |
| M | 580 | 1800 | 2700 | 11600 |
| N | 420 | 4100 | 6400 | 8900 |
| A、X和Y | B、Y和N |
| C、M和N | D、Y和M |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 电离能/kJ?mol-1 | I1 | I2 | I3 | I4 |
| A | 578 | 1817 | 2745 | 11578 |
| B | 738 | 1451 | 7733 | 10540 |
| 共价键 | C-C | C-N | C-S |
| 键能/kJ?mol-1 | 347 | 305 | 259 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 ,与其结构相似的化合物是
,与其结构相似的化合物是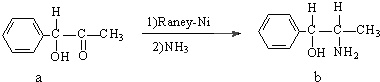
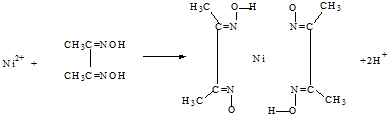
查看答案和解析>>
科目:高中化学 来源: 题型:
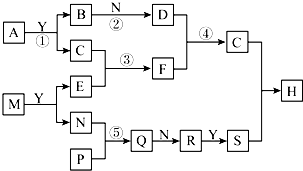 由化合物A、M开始,可发生如图所示的变化.已知A由两种元素组成,且两元素的质量比为1:3,B、P、Y都是由短周期元素形成的简单氢化物,常温下Y为无色液体,B、P均为可燃性气体,M也是由两种短周期元素组成化合物,且M的焰色反应为黄色,C是一种不溶于水的白色固体,Q属于酸性氧化物.(框图中生成的水均已略去)
由化合物A、M开始,可发生如图所示的变化.已知A由两种元素组成,且两元素的质量比为1:3,B、P、Y都是由短周期元素形成的简单氢化物,常温下Y为无色液体,B、P均为可燃性气体,M也是由两种短周期元素组成化合物,且M的焰色反应为黄色,C是一种不溶于水的白色固体,Q属于酸性氧化物.(框图中生成的水均已略去)查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com