
下列有关的离子方程式正确的是( )
A.氯化铝溶液中加入过量氨水:Al3++4NH3·H2O=AlO2-+4NH4+
B.铜片接电源正极,碳棒接电源负极,电解硫酸溶液:Cu+2H+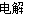 Cu2++H2↑
Cu2++H2↑
C.磷酸一氢钠溶液水【解析】
HPO42-+H2O PO43-+H3O+
PO43-+H3O+
D.实验室配制的亚铁盐溶液在空气中被氧化:4Fe2++O2+2H2O=4Fe3++4OH-
科目:高中化学 来源:2014高考化学二轮专题突破 专题十二常见非金属元素练习卷(解析版) 题型:选择题
下列有关物质用途的说法,错误的是( )
A.二氧化硫常用于漂白纸浆 B.漂粉精可用于游泳池水消毒
C.晶体硅常用于制作光导纤维 D.氧化铁常用于红色油漆和涂料
查看答案和解析>>
科目:高中化学 来源:2014高考化学二轮专题突破 专题六物质结构和元素周期律练习卷(解析版) 题型:选择题
几种短周期元素的原子半径及某些化合价见下表。分析判断下列说法正确的是( )
元素 代号 | A | B | D | E | G | H | I | J |
化合价 | -1 | -2 | +4、-4 | -1 | +5、-3 | +3 | +2 | +1 |
原子半径/nm | 0.071 | 0.074 | 0.077 | 0.099 | 0.110 | 0.143 | 0.160 | 0.186 |
A.I在DB2中燃烧生成两种化合物
B.A、H、J的离子半径由大到小顺序是H>J>A
C.G元素的单质不存在同素异形体
D.B和J能形成既含离子键又含共价键的化合物
查看答案和解析>>
科目:高中化学 来源:2014高考化学二轮专题突破 专题八电化学练习卷(解析版) 题型:选择题
研究发现,可以用石墨作阳极、钛网作阴极、熔融CaF2—CaO作电解质,利用如图所示装置获得金属钙,并以钙为还原剂还原二氧化钛制备金属钛。下列说法中,正确的是( )

A.由TiO2制得1 mol金属Ti,理论上外电路转移2 mol电子
B.阳极的电极反应式为C+2O2--4e-=CO2↑
C.在制备金属钛前后,整套装置中CaO的总量减少
D.若用铅蓄电池作该装置的供电电源,“+”接线柱应连接Pb电极
查看答案和解析>>
科目:高中化学 来源:2014高考化学二轮专题突破 专题五离子反应练习卷(解析版) 题型:选择题
某pH=1的工业废液,只可能含有以下离子中的若干种:H+、Mg2+、Ba2+、Cl-、CO32-、SO42-,现取两份100 mL溶液进行如下实验:
第一份加入足量AgNO3溶液,得干燥沉淀3.50 g。
第二份加足量BaCl2溶液后,得干燥沉淀2.33 g,经足量盐酸洗涤、干燥后,沉淀质量不变。
根据上述实验,以下推测正确的是( )
①一定存在Mg2+ ②可能存在CO32- ③一定存在Cl- ④可能存在Ba2+ ⑤可能存在Mg2+
A.①③ B.②③ C.③⑤ D.④⑤
查看答案和解析>>
科目:高中化学 来源:2014高考化学二轮专题突破 专题二化学用语及常用计量练习卷(解析版) 题型:填空题
乙烯和乙烷的混合气体共a mol,与b mol O2共存于一密闭容器中,点燃后充分反应,乙烯和乙烷全部消耗完,得到CO和CO2的混合气体和45 g H2O,试求:
(1)当a=1时,乙烯和乙烷的物质的量之比n(C2H4)∶n(C2H6)= 。
(2)当a=1,且反应后CO和CO2的混合气体的物质的量为反应前O2的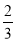 时,b= ,得到的CO和CO2的物质的量之比n(CO)∶n(CO2)= 。
时,b= ,得到的CO和CO2的物质的量之比n(CO)∶n(CO2)= 。
(3)a的取值范围是 。
查看答案和解析>>
科目:高中化学 来源:2014高考化学二轮专题突破 专题二化学用语及常用计量练习卷(解析版) 题型:选择题
下列说法正确的是( )
A.4.2 g丙烯中所含的共价键数目为0.6×6.02×1023
B.含1 mol H2SO4的浓硫酸与足量铜反应转移的电子总数为6.02×1023
C.相同条件下,1 L CO和H2的混合气体完全燃烧消耗0.5 L O2
D.相同物质的量的OH-和CH3+含有相同数目的电子
查看答案和解析>>
科目:高中化学 来源:2014高考化学二轮专题突破 专题三溶液组成的计量及其应用练习卷(解析版) 题型:填空题
盐泥是氯碱工业中的废渣,主要成分是镁的硅酸盐和碳酸盐(含少量铁、铝、钙的盐)。实验室以盐泥为原料制取MgSO4·7H2O的实验过程如下:
―→―→产品
已知:①室温下Ksp[Mg(OH)2]=6.0×10-12。②在溶液中,Fe2+、Fe3+、Al3+从开始沉淀到沉淀完全的pH范围依次为7.1~9.6、2.0~3.7、3.1~4.7。③三种化合物的溶解度(S)随温度变化的曲线如图所示。

(1)在盐泥中加入稀硫酸调pH为1~2以及煮沸的目的是_____________________。
(2)若室温下的溶液中Mg2+的浓度为6.0 mol·L-1,则溶液pH≥________才可能产生Mg(OH)2沉淀。
(3)由滤液Ⅰ到滤液Ⅱ需先加入NaClO调溶液pH约为5,再趁热过滤,则趁热过滤的目的是__________________,滤渣的主要成分是______________________。
(4)从滤液Ⅱ中获得MgSO4·7H2O晶体的实验步骤依次为①向滤液Ⅱ中加入______________;②过滤,得沉淀;③________________;④蒸发浓缩,降温结晶;⑤过滤、洗涤得产品。
(5)若获得的MgSO4·7H2O的质量为24.6 g,则该盐泥中镁[以Mg(OH)2计]的百分含量约为________(MgSO4·7H2O的相对分子质量为246)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com