
��1������ǽ��Ƽ����Դ�� �����ӡ�
��2����ѧ�Ƶ�ԭ�������û�ѧ��Ӧ���ɽ������ʳ����ڶƼ������γɵĶƲ㡣
������ͭ�ν��л�ѧ��ͭ��Ӧѡ�� �������������ԭ��������֮��Ӧ��
��ij��ѧ��ͭ�ķ�Ӧ�������ҺpH�仯����ͼ��ʾ���ö�ͭ�����У���ҺpH������12.5���ҡ���ͼ����Ϣ������ʹ��Ӧֹͣ�ķ����� ��
��3���������ȡ����ͭ������ʾ��ͼ���£�
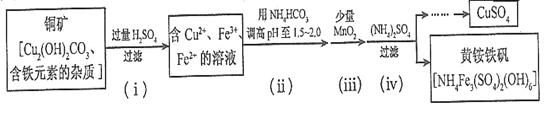
�ٲ��裨i����Cu2(OH)2CO3������Ӧ�Ļ�ѧ����ʽΪ ��
�ڲ��裨ii�������Լ������pH���õ������� (�����ӷ���)��
���ڲ��裨iii�������ķ�Ӧ�У�1molMnO2ת��2 mol���ӣ��÷�Ӧ�����ӷ���ʽΪ��
��
�ܲ��裨iv����ȥ���ʵĻ�ѧ����ʽ�ɱ�ʾΪ
3Fe3����NH4����2SO42����6H2O=NH4Fe3(SO4)2(OH)6����6H�������˺�ĸҺ��pH=2.0��
c��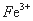 ��=a mol·L—1��c��
��=a mol·L—1��c��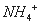 ��=b mol·L—1��c��
��=b mol·L—1��c��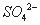 ��=d mol·L—1��
��=d mol·L—1��
�÷�Ӧ��ƽ�ⳣ��K= ���ú�a��b��d�Ĵ���ʽ��ʾ����
��֪ʶ�㡿���ԭ����������ԭ��Ӧ F4 B3 G4
���𰸽�������1������
��2���ٻ�ԭ�� �ڵ�����Һ��pH��8—9 ֮�䡣
(3) ��Cu2(OH)2CO3+2H2SO4=2CuSO4+CO2��+3H2O
��̼��������ӡ�
��MnO2+2Fe2++4H+=Mn2++2Fe3++2H2O
��K= 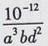 ��
��
��������1��������ڵ�⣬���ʱ����������ԭ��Ӧ�����Խ��Ƽ����Դ�ĸ������ӡ�
��2��������ͭ�ν��л�ѧ��ͭ��Ҳ���ǽ�ͭ���ӻ�ԭΪͭ������Ҫ�û�ԭ����֮��Ӧ�� �ڵ�����Һ��pH��8—9 ֮�䡣
(3) �ټ�ʽ̼��ͭ�����ᷴӦ�ķ���ʽֱ��д���ù۲취��ƽ��Cu2(OH)2CO3+2H2SO4=2CuSO4+CO2��+3H2O
�ڸ�������ͼ����̼�����Ŀ���ǽ���Һ��PH���ߣ����������õ���̼��������ӡ�
���ڲ��裨iii�������ķ�Ӧ�У�1molMnO2ת��2 mol���ӣ��̵Ļ��ϼ���+4����Ϊ+2�����Ļ��ϼ���+2���ߵ�+3����Ӧ�����ӷ���ʽΪ��MnO2+2Fe2++4H+=Mn2++2Fe3++2H2O
���ȸ��ݵ���غ���������ӵ�Ũ�ȣ�Ȼ�����ƽ�ⳣ���ı���ʽ���ɽ��
��˼·�㲦�����⿼���˵��ԭ����������ԭ��Ӧ�Ļ���ԭ�����ؼ��������Ķ�������


 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��NA��ʾ�����ӵ�������ֵ��������������ȷ����(����)
A�����³�ѹ�£�46 g�л���C2H6O�к��м��Լ�����Ŀһ��Ϊ7NA
B����״���£�22.4 L���Ȼ�̼�������еĹ��ۼ���ĿΪ4NA
C����״���£�5.6 L NO��5.6 L O2��ɵĻ������������ԭ����ΪNA
D�����³�ѹ�£�33.6 L������56 g����ַ�Ӧ��ת�Ƶĵ�����Ϊ3NA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
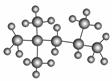
����ֵ��������ʾ���͵�������������������ı���̶���С��һ�㽫������ֵ�궨Ϊ100����ͼ����������ӵ����ģ�ͣ����������ϵͳ����Ϊ(����)
A��1,1,3,3�ļ����� B��2,2,4��������
C��2,4,4�������� D��2,3,4��������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��Ҫ��ش��������⡣
(1) 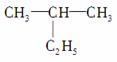 ����Ϊ��2�һ����顱������ԭ����____________________����
����Ϊ��2�һ����顱������ԭ����____________________����
������Ϊ��3�����顱������ԭ����__________________����ȷ������Ϊ________��
(2)  ��������________________��
��������________________��
(3)2,6����4�һ�����Ľṹ��ʽ��______________________��1 mol��������ȫȼ������������______mol��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��100mL��FeBr2��Һ�У�ͨ���״����Cl2 5.04L��Cl2ȫ������ԭ�������Һ��c(Br-)=c(Cl-)����ԭFeBr2��Һ�����ʵ���Ũ����
A��0.75mol/L B��1.5mol/L C��2mol/L D��3mol/L
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��ҵ��ˮ�г�����һ������Cr2O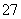 ��CrO
��CrO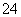 �����ǻ����̬ϵͳ��ɺܴ�������л�ԭ�������dz��õ�һ�ִ����������������£�
�����ǻ����̬ϵͳ��ɺܴ�������л�ԭ�������dz��õ�һ�ִ����������������£�
CrO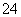
 Cr2O
Cr2O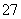
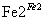 Cr3��
Cr3�� Cr(OH)3��
Cr(OH)3��
���еڢٲ��д���ƽ�⣺2CrO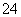 (��ɫ)��2H��
(��ɫ)��2H�� Cr2O
Cr2O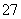 (��ɫ)��H2O�������й�˵����ȷ����
(��ɫ)��H2O�������й�˵����ȷ����
A���ڢٲ���2v(Cr2O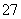 )��v(CrO
)��v(CrO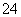 )ʱ���ﵽ��ƽ��״̬
)ʱ���ﵽ��ƽ��״̬
B����������ƽ�⣬��������ϡ�������Һ��ɫ���ɫ����������CrO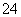 ������
������
C�������£�Cr��OH��3���ܶȻ�Ksp=10-32��Ҫʹc��Cr3+������10-5mol/L����Һ��pHӦ����9
D���ڢڲ��У���ԭ0.1 mol Cr2O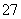 ��Ҫ91.2 g FeSO4
��Ҫ91.2 g FeSO4
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��ͬλ��ʾ�ٷ������ڷ�Ӧ�������о������з�Ӧ��ת����ͬλ��ʾ�ٱ�ʾ��ȷ���� �� ��
A��2Na218O2 + 2H2O = 4Nal8OH + O2��
B��NH4Cl + 2H2O  NH3·2H2O + HCl
NH3·2H2O + HCl
C��2KMnO4 + 5H218O2 + 3H2SO4= K2SO4 + 2MnSO4 + 518O2�� + 8H2O
D��K37ClO3 + 6HCl = K37Cl + 3Cl2�� + 3H2O
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��ˮ�к��д�����ѧ����,�Ǿ�Ļ�ѧ��Դ����,���ú�ˮ��Դ���Ի�ȡһϵ�л� ����Ʒ��
����Ʒ��

(1)��д����ⱥ��ʳ��ˮ�Ļ�ѧ����ʽ:�������������������� ������������������
������������������
(2)�� ��ⱥ��ʳ��ˮ��װ����,��������������Ϊ������
��ⱥ��ʳ��ˮ��װ����,��������������Ϊ������
Ϊ�˽����ܺ�,��������ȼҵ��Ʒ�������������ķ����� ���ƹ�Ӧ�á�
���ƹ�Ӧ�á�
������ͼ,��ش���������:
(3)X����Ϊ����(�ѧʽ)��
(4)д��ͼ��ȼ�ϵ�ظ����ĵ缫��Ӧ:��������������������������
(5)����Ũ���ᴦ��������,����������Һ�м�����,���ʱ��Һ�к���Fe2+��TiO2+���� ��Mg2+�������ӡ�������,���������Ӷ�Ӧ������������ܽ��(S/mol·L-1)����ҺpH�Ĺ�ϵ��ͼ��ʾ��
��Mg2+�������ӡ�������,���������Ӷ�Ӧ������������ܽ��(S/mol·L-1)����ҺpH�Ĺ�ϵ��ͼ��ʾ��

��֪����������Һ��ˮϡ�ͺ�,��������������ɫ����,��д���÷�Ӧ�����ӷ���ʽ:��������������������
(6)��֪:��Mg(s)+Cl2(s) MgCl2(s)����H=-641 kJ·mol-1
MgCl2(s)����H=-641 kJ·mol-1
��Ti(s)+Cl2(g) TiCl4(l)����H=-385 kJ·mol-1
TiCl4(l)����H=-385 kJ·mol-1
д��Mg��TiCl4��Ӧ���Ȼ�ѧ����ʽ:���������������������������������� ��������;�÷�Ӧ�����л�Ӧ���Ƶķ�Ӧ����������������
��������;�÷�Ӧ�����л�Ӧ���Ƶķ�Ӧ����������������
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com