

分析 (1)氰化钠易发生水解产生氰化氢;
(2)氰化钠与双氧水反应生成氨气和碳酸氢钠;
(3)流程分析含CN-废水调整溶液PH加入NaClO溶液,氧化CN-离子反应生成CNO-的废水,含Cr2O72-的废水调整溶液PH加入Na2S2O3发生氧化还原反应得到含硫酸根离子的废水,和含CNO-的废水继续处理得当待测水样.
1)从流程分析物质的转化关系和试剂选择分析所用方法;
2)碱性条件下,CN-离子与NaClO发生氧化还原反应生成CNO-、Cl-离子,据此写出离子方程式;
3)利用每0.4molCr2O72-转移2.4mol的电子来计算被还原后Cr元素的化合价,再书写离子方程式;
4)根据氧化还原反应中得失电子数相等,再结合原子守恒进行计算.
解答 解:(1)氰化钠易发生水解产生氰化氢,方程式为CN-+H2O?HCN+OH-,故答案为:CN-+H2O?HCN+OH-;
(2)氰化钠与双氧水反应生成氨气和碳酸氢钠,方程式为NaCN+H2O2+H2O═NaHCO3+NH3↑,故答案为:NaCN+H2O2+H2O═NaHCO3+NH3↑;
(3)流程分析含CN-废水调整溶液PH加入NaClO溶液,氧化CN-离子反应生成CNO-的废水,含Cr2O72-的废水调整溶液PH加入Na2S2O3发生氧化还原反应得到含硫酸根离子的废水,和含CNO-的废水继续处理得当待测水样.
1)从流程看,CN-转化为CNO-,化合价升高被氧化剂氧化,Cr2O72-转化为Cr3+化合价降低,故还原剂还原,故采用方法为氧化-还原法;
故答案为:d;
2)步骤②中,无气体放出,CN-被ClO-氧化为CNO-,则因为是在碱性环境中,故ClO-只能被还原为Cl-,反应式为:CN-+ClO-═CNO-+Cl-;
故答案为:CN-+ClO-═CNO-+Cl-;
3)每0.4molCr2O72-转移2.4mol的电子,设还原后Cr元素的化合价为x,则0.4mol×2×(6-x)=2.4mol,解得x=+3,则离子反应为3S2O32-+4Cr2O72-+26H+═6SO42-+8Cr3++13H2O,
故答案为:3S2O32-+4Cr2O72-+26H+═6SO42-+8Cr3++13H2O;
4)处理1mol Cr2O72-,需加入a mol FeSO4•7H2O,根据铬原子守恒得,1mol Cr2O72-完全反应后生成 $\frac{2}{2-x}$molFeⅡ[FeⅢx•CrⅢ2-x]O4,根据铁原子守恒得amol=$\frac{2(1+x)}{2-x}$mol①,该反应中得失电子数相等,1mol×2×3=$\frac{2}{2-x}$mol×(3-2)×x,解得x=1.5,将x=1.5代入①得a=10,
故答案为:D.
点评 本题考查物质的分离和提纯,为高频考点,涉及实验基本操作、氧化还原反应等知识点,明确流程图中化学反应原理、基本操作方法是解本题关键,难点是(4)的氧化还原反应的计算,题目难度中等.


 王后雄学案教材完全解读系列答案
王后雄学案教材完全解读系列答案科目:高中化学 来源: 题型:选择题
| 实验目的 | 实验操作 | 实验原理 | |
| A | 提纯混有少量硝酸钾的氯化钠 | 在较高温度下制得浓溶液再冷却结晶、过滤、干燥 | 氯化钠溶解度随温度升高变化不大,而硝酸钾溶解度随温度升高显著增大 |
| B | 配制FeCl3溶液 | 将FeCl3固体溶解于适量硫酸溶液 | H+抑制FeCl3水解 |
| C | 检验溶液中是否含有NH4+ | 取少量试液于试管中,加入NaOH溶液并加热,用湿润的红色石蕊试纸检验产生的气体 | NH3溶于水后溶质的主要存在形式是NH4+、OH- |
| D | 验证Fe(OH)3的溶解度小于Mg(OH)2 | 将FeCl3溶液加入Mg(OH)2悬浊液中,振荡 | 3Mg(OH)2+2Fe3+?2Fe(OH)3+3Mg2+ |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
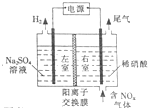 电解法处理含氮氧化物废气,可回收硝酸,具有较高的环境效益和经济效益.实验室模拟电解法吸收NOx的装置如图所示(图中电极均为石墨电极).
电解法处理含氮氧化物废气,可回收硝酸,具有较高的环境效益和经济效益.实验室模拟电解法吸收NOx的装置如图所示(图中电极均为石墨电极).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2S的水溶液中滴加新制氯水后出现浑浊 | |
| B. | Cl原子最外层有7个电子,而S原子最外层有6个电子 | |
| C. | HCl水溶液的酸性强于H2S水溶液的酸性 | |
| D. | HClO4的酸性比H2SO3的酸性强 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | Al和Fe2O3的铝热反应 | B. | Ba(OH)2•8H2O与NH4Cl的反应 | ||
| C. | NaOH溶液与CH3COOH溶液反应 | D. | 甲烷在O2中的燃烧反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 天然气、酒精和汽油分别属于化石能源、可再生能源和二次能源 | |
| B. | 富含N、P元素的生活用水可以直接用来灌溉农田 | |
| C. | 液晶态介于晶体状态和液态之间,液晶具有一定程度的晶体的有序性和液体的流动性 | |
| D. | 我国油品从国 IV 汽油升级到国 V 汽油,有助于减少酸雨、雾霾,提高空气质量 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
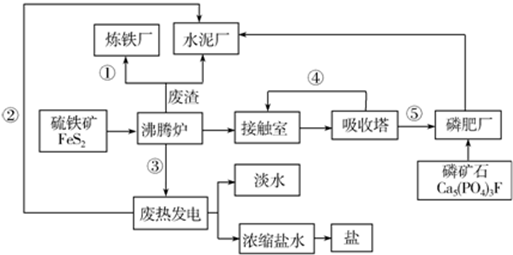
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
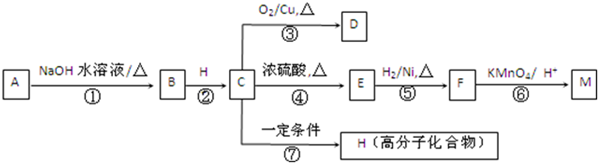
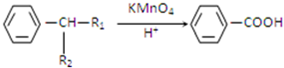 (R1、R2代表烃基或氢原子)
(R1、R2代表烃基或氢原子)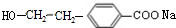 、
、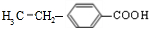 ;
; ;反应⑦的化学方程式为
;反应⑦的化学方程式为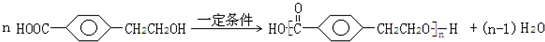 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com