
| A�� | ���ṩ0.4 mol HCl��MnO2����������Ƶ�����4.48 L | |
| B�� | ���ṩ0.4 mol HCl��MnO2��������ת�Ƶ�����һ��Ϊ0.1mol | |
| C�� | ����0.4 mol HCl�μӷ�Ӧ������Ƶ�����2.24 L | |
| D�� | ����0.4 mol HCl������������Ƶ�����2.24 L |
���� Ũ������������̷�Ӧ��ȡ����������MnO2+4HCl��Ũ��$\frac{\underline{\;\;��\;\;}}{\;}$MnCl2+2H2O+Cl2������ϡ������������̲���Ӧ���Դ������
��� �⣺A�����ṩ0.4 mol HCl��MnO2�������淴Ӧ�Ľ��У�ϡ�����Ӧ������������С��0.1mol�������С��2.24L����A����
B�����ṩ0.4 mol HCl��MnO2�������淴Ӧ�Ľ��У�ϡ�����Ӧ������������С��0.1mol����ת�Ƶ�����С��Ϊ0.2mol����B����
C������0.4 mol HCl�μӷ�Ӧ���ɷ�Ӧ��֪����0.1mol���壬����Ƶ�����2.24 L����C��ȷ��
D������0.4 mol HCl����������Clԭ���غ��֪����������Ϊ0.2mol������Ƶ�����4.48 L����D����
��ѡC��
���� ���⿼��������ԭ��Ӧ�ļ��㣬Ϊ��Ƶ���㣬���շ����ķ�Ӧ�����ʵ����Ĺ�ϵΪ���Ĺؼ������ط�������������Ŀ��飬ע��ϡ������������̲���Ӧ����Ŀ�ѶȲ���



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 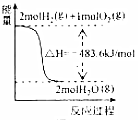 ��ʾH2��O2������Ӧ�����е������仯����H2��ȼ����Ϊ483.6kJ•mol-1 | |
| B�� | 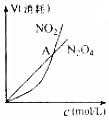 ��ʾ���º��������·����Ŀ��淴Ӧ2NO2��g��?N2O4��g���У������ʵ�Ũ��������������֮��Ĺ�ϵ�����н���A��Ӧ��״̬Ϊ��ѧƽ��״̬ | |
| C�� | 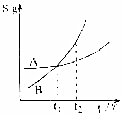 ��ʾA��B�����ʵ��ܽ�����¶ȱ仯�������A��B������Һ�ֱ���t1��������t2��ʱ�����ʵ���������A=B | |
| D�� | 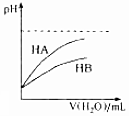 ��ʾ�����£�ϡ��HA��HB�������ϡ��Һʱ����ҺpH���ˮ���ı仯����ͬŨ�ȵ�NaA��Һ��pH����NaB��Һ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | pH��Ϊ2�Ĵ���������ˮϡ��100����������Һ��pH��������� | |
| B�� | pHΪ11�İ�ˮ��pHΪ3��������Һ�������ϣ�������Һ��c��Cl-����c��NH4+����c��OH-����c��H+�� | |
| C�� | Ũ�Ⱦ�Ϊ0.1 mol/L��NaOH��Һ��CH3COONa��Һ�������Ϻ����Һ��c��Na+��+c��CH3COO-��=c��OH-��+c��H+�� | |
| D�� | Ũ�Ⱦ�Ϊ0.1mol/L�Ĵ����CH3COONa��Һ�������ϣ���Һ�������й�ϵ��c��CH3COOH��+2c��H+��=c��CH3COO-��+2c��OH-�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
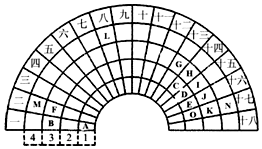 Ԫ�����ڱ�����ʽ���ֶ�������ͼ������Ԫ�����ڱ���һ���֣�1��36��Ԫ�أ����Ա���ѧ����Ԫ�����ڱ���˼������Ԫ�����ڱ��������ɣ����ش��������⣺
Ԫ�����ڱ�����ʽ���ֶ�������ͼ������Ԫ�����ڱ���һ���֣�1��36��Ԫ�أ����Ա���ѧ����Ԫ�����ڱ���˼������Ԫ�����ڱ��������ɣ����ش��������⣺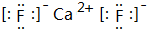 ���õ���ʽ��ʾCJ2���γɹ��̣�
���õ���ʽ��ʾCJ2���γɹ��̣�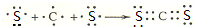 ��
���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
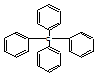
| A�� | �����ڱ���ͬϵ�� | B�� | ����������ԭ�ӹ�ƽ�� | ||
| C�� | ���ķ���ʽΪC25H24 | D�� | ����һ�ȴ���������ͬ���칹�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ����蘆��ܶȱȽ�����С | B�� | ����蘆��۵�Ƚ����Ƹ� | ||
| C�� | Cs��H2O�ܾ��ҷ�Ӧ������������ը | D�� | ̼���������ˮ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 8 | B�� | 9 | C�� | 11 | D�� | 12 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ������������淋����ʵ���Ϊn��2-x��mol | |
| B�� | ������ˮ��Cr2O72- �����ʵ���Ϊnxmol | |
| C�� | ��Ӧ�з���ת�Ƶĵ�����Ϊ3n mol | |
| D�� | ��FeO•FeyCrxO3��3x=y |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com