
硫酸亚锡(SnSO4)是一种重要的硫酸盐,广泛应用于镀锡工业。某研究小组设计SnSO4制备路线如下:
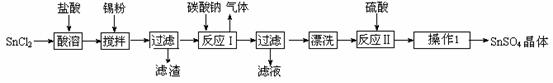
查阅资料:
Ⅰ.酸性条件下,锡在水溶液中有Sn2+、Sn4+两种主要存在形式,Sn2+易被氧化。
Ⅱ.SnCl2易水解生成碱式氯化亚锡, Sn相对原子质量为119
回答下列问题:
(1)锡原子的核电荷数为50,锡元素在周期表中的位置是 。
(2)操作Ⅰ是 。
(3)SnCl2粉末需加浓盐酸进行溶解,请用平衡移动原理解释原因 。
(4)加入Sn粉的作用有两个:①调节溶液pH ② 。
(5)反应Ⅰ得到沉淀是SnO,得到该沉淀的离子反应方程式是 。
(6)酸性条件下,SnSO4还可以用作双氧水去除剂,发生反应的离子方程式是 。
(7)该小组通过下列方法测定所用锡粉的纯度(杂质不参与反应):
①将试样溶于盐酸中,发生的反应为:Sn + 2HCl===SnCl2 + H2↑;
②加入过量的FeCl3 ;
③用已知浓度的K2Cr2O7滴定生成的Fe2+,发生的反应为:
6FeCl2 + K2Cr2O7 + 14HCl ===6FeCl3 + 2KCl + 2CrCl3 +7H2O
取1.226 g 锡粉,经上述各步反应后,共用去0.100 mol/L K2Cr2O7溶液32.0ml。锡粉中锡的质量分数是 。
 应用题天天练四川大学出版社系列答案
应用题天天练四川大学出版社系列答案科目:高中化学 来源: 题型:
某醛的分子式为C5H10O,其属于醛类的同分异构体种数为______种;写出属于酮的三种同分异构体:________、________、________。
查看答案和解析>>
科目:高中化学 来源: 题型:
有A、B、C、D、E、F六种短周期元素,原子序数依次增大。已知A的一种核素的原子核为质子,B原子的最外层电子数是次外层电子数的2倍。B原子的最外层电子数是D、E原子最外层电子数之和,C原子的最外层电子数是D、F原子最外层电子数之和。下列推论正确的是 ( )
A.A、B两元素只能形成一种化合物
B.D、E两元素的最高价多种氧化物对应的水化物均为强碱
C.C的气态氢化物的稳定性一定小于F的气态氢化物
D.C、F两种元素可能形成原子晶体型的新型无机非金属材料
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法中不正确的是( )
A.HF稳定性比HCl强 B.Mg失电子能力比Ca弱
C.NaCl与NH4Cl含有的化学键类型相同 D.等物质的量的C2H6和H202含电子数相同
查看答案和解析>>
科目:高中化学 来源: 题型:
下列推断正确的是( )
A.由H+(aq)+OH-(aq)=H20(1) △H=-57.3 kJ·mol-1,可知含1 mo1 CH3COOH的溶液与含1 mol NaOH的溶液混合,放出热量为57.3 kJ
B.由C(石墨)=C(金刚石) △H=+1.9 kJ·mol-1,可知石墨比金刚石更稳定
C.由N2(g)+3H2(g)=2NH3(g) △H=-92.4 kJ·mol-1,可知将1 mol N2(g)和3 mol H2(g)置于密闭容器中充分反应后放出热量为92.4 kJ
D.由△G=△H-T△S可知,所有的放热反应都能自发进行
查看答案和解析>>
科目:高中化学 来源: 题型:
在一定温度下,反应A2(g)+B2(g) 2AB(g)达到平衡的标志是
2AB(g)达到平衡的标志是
A.容器内的总压不随时间变化
B.单位时间生成nmol的A2同时生成2nmol的AB
C.单位时间生成2nmol的AB同时消耗nmol的B2
D.单位时间生成nmol的A2同时生成nmol的B2
查看答案和解析>>
科目:高中化学 来源: 题型:
下列事实中不能用勒夏特列原理解释的是
A.在溴水中存在如下平衡:Br2+H2O HBr+HBrO,当加入NaOH溶液后颜色变浅
HBr+HBrO,当加入NaOH溶液后颜色变浅
B.对2NO2(g)  N2O4(g) 平衡体系,增加压强使颜色变浅
N2O4(g) 平衡体系,增加压强使颜色变浅
C.反应CO+NO2 CO2+NO △H < 0升高温度使平衡向逆方向移动
CO2+NO △H < 0升高温度使平衡向逆方向移动
D.向双氧水溶液中滴入FeCl3 溶液后,产生气泡速率加快
查看答案和解析>>
科目:高中化学 来源: 题型:
氨的合成是重要的一项化工生产。已知合成氨有关能量变化的图像如图 1。
1。
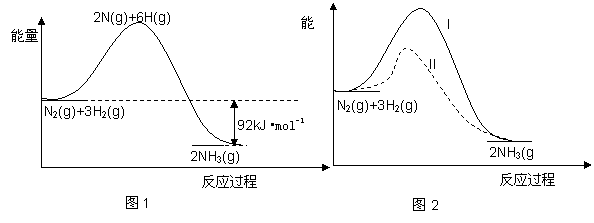
(1)反应 N2(g)+3H2(g) 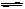 2NH3(g) △H= ;
2NH3(g) △H= ;
(2)化学反应可视为旧健断裂和新键形成的过程,化学键的键能是形成(或拆开)1 mol化学键时释放(或吸收)的能量。现提供以下化学键的键能(kJ·mol-1):H—H:436,N≡N:946,则N—H的键能是 kJ·mol-1;
mol化学键时释放(或吸收)的能量。现提供以下化学键的键能(kJ·mol-1):H—H:436,N≡N:946,则N—H的键能是 kJ·mol-1;
(3)在一定条件下按图2实线I进行,改变某条件按图2虚线II进行,则该条件可能是 ;
(4)在一个密闭容器中加入1molN2、3mol H2,一定条件下充分反应,其热效应始终小于92 kJ,请说明原因 ;
(5)在一个密闭容器中加入amolN2、bmol H2,达到平衡时n(N2):n(H2)=1:3,则a:b= 。
查看答案和解析>>
科目:高中化学 来源: 题型:
苹果酸是一种常见的有机酸,其结构简式为:
 。
。
(1)苹果酸分子所含官能团的名称是________、________。
(2)苹果酸不可能发生的反应有________(选填序号)。
①加成反应 ②酯化反应 ③加聚反应 ④氧化反应
⑤消去反应 ⑥取代反应
(3)物质A(C4H5O4Br)在一定条件下可发生水解反应,得到苹果酸和溴化氢。由A制取苹果酸的化学方程式是
________________________________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com