
| A. | 推广使用煤的液化技术,从根本上减少二氧化碳等温室效应的排放 | |
| B. | 胶体和溶液的本质区别是胶体具有丁达尔现象 | |
| C. | SiO2既能与氢氧化钠溶液反应又能与氢氟酸反应,SiO2是两性氧化物 | |
| D. | 使用含有氯化钙的融雪剂会加速桥梁的腐蚀 |
分析 A、煤经液化能变为甲醇;
B、胶体本质特征为分散质粒度介于1-100nm;
C、SiO2既能与氢氧化钠溶液反应又能与氢氟酸反应,但是二氧化硅不能与学生、硫酸等强酸反应,不属于两性氧化物;
D、原电池能加快化学反应的速率.
解答 解:A、煤经液化能变为甲醇,燃烧仍生成二氧化碳,故不能减少二氧化碳的排放,故A错误;
B、胶体和溶液的本质区别是分散质粒度大小不同,所以可以用丁达尔现象来区分,故B错误;
C、SiO2为酸性氧化物,能与氢氧化钠溶液反应,不能与强酸反应,与氢氟酸反应是由于氟化氢具有腐蚀性,所以SiO2不是两性氧化物,故C错误;
D、氯化钙是电解质,能与桥梁中的钢构成原电池,故D正确;
故选D.
点评 本题考查了物质的用途,熟悉过二氧化硅、胶体的性质,明确金属电化学腐蚀原理是解题关键,题目难度不大.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
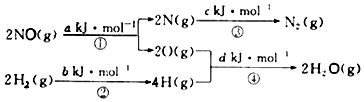
| A. | 0.5(a+b-c-d)kJ/mol | B. | 0.5(c+a-d-b)kJ/mol | ||
| C. | 0.5(c+d-a-b)kJ/mol | D. | 0.5(c+d-a-b)kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
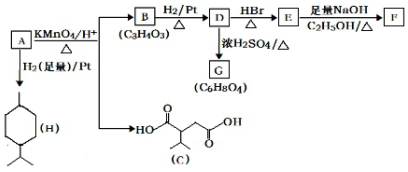
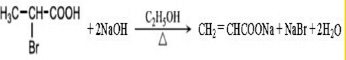
 $→_{△}^{KMnO_{4}/H+}$
$→_{△}^{KMnO_{4}/H+}$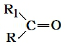 +R2COOH
+R2COOH .
. .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
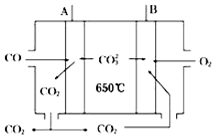 人们应用原电池原理制作了多种电池,以满足不同的需要.以下每小题中的电池广泛使用于日常生活、生产和科学技术等方面,请根据题中提供的信息,填写空格.
人们应用原电池原理制作了多种电池,以满足不同的需要.以下每小题中的电池广泛使用于日常生活、生产和科学技术等方面,请根据题中提供的信息,填写空格.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 铁是生产生活中应用最广泛的金属,炼铁技术备受关注,已知:
铁是生产生活中应用最广泛的金属,炼铁技术备受关注,已知:| 编号 | 容器 | 起始时物质的量 mol | 平衡时物质的量/mol | 平衡常数(K) | |
| Fe2O3 | CO | Fe | |||
| 1 | 恒温 | 0.5 | 1.5 | 0.8 | K1 |
| 2 | 恒温 | 2 | 3 | m | K2 |
| 3 | 绝热 | 1 | 1.5 | n | K3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
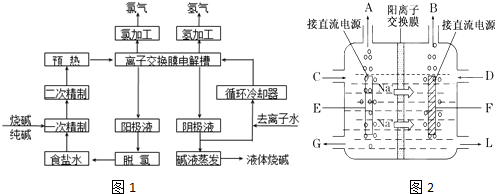
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2 min | B. | 3 min | C. | 6 min | D. | 9 min |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com