

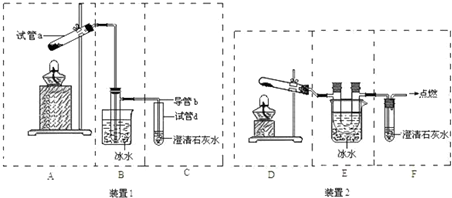
 ,
, ;
;
| ||


 备战中考寒假系列答案
备战中考寒假系列答案科目:高中化学 来源: 题型:

| M(OH)n | Ksp | pH | |
| 开始沉淀 | 沉淀完全 | ||
| Al(OH)3 | 1.9×10-23 | 3.4 | 4.2 |
| Fe(OH)3 | 3.8×10-38 | 2.5 | 2.9 |
| Ni(OH)2 | 1.6×10-14 | 7.6 | 9.8 |
查看答案和解析>>
科目:高中化学 来源: 题型:

| 铵盐质量 | 10.00g | 20.00g | 30.00g | 40.00g |
| 浓硫酸增加的质量 | a g | a g | 0.68g | 0g |
查看答案和解析>>
科目:高中化学 来源: 题型:
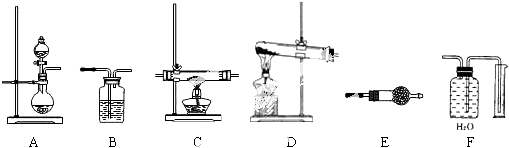
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、甲组和乙组实验能观察到相同的现象 |
| B、乙组和丙组实验均能观察到蓝色沉淀 |
| C、乙组实验产生的沉淀质量比丁组多 |
| D、戊组实验产生的沉淀质量比丙组少 |
查看答案和解析>>
科目:高中化学 来源: 题型:
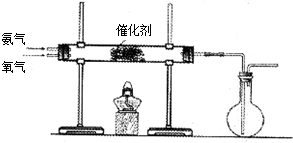
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、向沸水中逐滴加入少量饱和FeCl3溶液,可制得Fe(OH)3胶体 |
| B、能使润湿的淀粉KI试纸变成蓝色的物质一定是C12 |
| C、某溶液加入CCl4,CCl4层显紫色,证明原溶液中存在I- |
| D、HCl溶液和NaCl溶液均通过离子导电,所以HCl和NaCl均是离子化合物 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com