
【题目】因存在浓度差而产生电动势的电池称为浓差电池。利用如图所示装置进行实验,开始先闭合K2,断开Kl,电解一段时间后,再断开K2,闭合Kl,形成浓差电池,电流计指针偏转(Ag+浓度越大,氧化性越强)。下列说法不正确的是
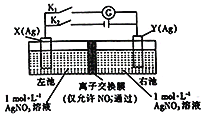
A.闭合K2,断开Kl,NO3-从左池向右池移动
B.断开K2,闭合K1,X为正极
C.闭合K2,断开Kl一段时间后,右池c(AgNO3)增大
D.装置安装后若直接闭合Kl,电流计指针不发生偏转,但往左池加入适当的氨水后,指针偏转
【答案】B
【解析】
闭合K2,断开K1,为电解装置,Y为阳极,阳极金属银被氧化,X为阴极,阴极析出银,NO3-向阳极移动,左池浓度增大,右池浓度减小;
断开K2,闭合K1后,形成浓差电池,电流计指针偏转(Ag+浓度越大氧化性越强),可知Y为正极,发生还原反应,X为负极,发生氧化反应,NO3-向负极移动。
A. 闭合K2,断开Kl,右边(Y极)为阳极,NO3-从左池向右池移动,正确;
B. 断开K2,闭合K1,X为负极,不正确;
C. 闭合K2,断开Kl一段时间后,右池c(AgNO3)增大,正确;
D. 装置安装后若直接闭合Kl,电流计指针不发生偏转,但往左池加入适当的氨水后,左池银离子浓度降低,产生浓度差,形成原电池,指针偏转,正确。
答案选B。


科目:高中化学 来源: 题型:
【题目】设NA代表阿伏加德罗常数,下列说法正确的是( )
A.5.6g铁与足量盐酸反应转移的电子数为0.3NA
B.100mL2.0mol/L的氢氧化钠溶液与氢氧化钡溶液中氢氧根离子均为0.2NA
C.标准状况下,22.4L氦气与11.2L氯气所含原子数均为NA
D.16g18O2与16g16O3所含的中子数均是8NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,对于密闭容器中进行的可逆反应A(g)+3B(g)![]() 2C(g),下列说法中,能说明这一反应已经达到化学平衡状态的是( )
2C(g),下列说法中,能说明这一反应已经达到化学平衡状态的是( )
A.生成B的速率与C分解的速率相等
B.A、B、C的浓度相等
C.单位时间生成nmolA,同时生成2nmolC
D.A、B、C的分子数之比为1:3:2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水杨酸冬青油、阿司匹林的结构简式如图,下列说法不正确的是

A. 由水杨酸制冬青油的反应是取代反应
B. 阿司匹林的分子式为C9H8O4,在一定条件下水解可得水杨酸
C. 冬青油苯环上的一氯取代物有4种
D. 可用NaOH溶液除去冬青油中少量的水杨酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)在2L的密闭容器中放入4molN2O5,发生如下反应:2N2O5(g)![]() 4NO2(g)+O2(g)。反应至5min时,测得N2O5转化了20%,则v(NO2)为___,c(N2O5)为___,O2的物质的量浓度为___。
4NO2(g)+O2(g)。反应至5min时,测得N2O5转化了20%,则v(NO2)为___,c(N2O5)为___,O2的物质的量浓度为___。
(2)某温度时,在一个2L的密闭容器中,X、Y、Z三种物质的物质的量随时间变化的曲线如图所示。根据图中数据填空:

①该反应的化学方程式为___。
②反应至平衡时,v(X)为___,c(Z)为___。
③若X、Y、Z均为气体,则达平衡时,容器内混合气体的平均相对分子质量比起始投料时___(填“增大”“减小”或“相等”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于放热反应Zn+H2SO4===ZnSO4+H2↑,下列叙述正确的是( )

A. 反应过程中的能量关系可用上图表示
B. 1 mol Zn的能量大于1 mol H2的能量
C. 若将其设计为原电池,则锌作正极
D. 若将其设计为原电池,当有32.5 g Zn溶解时,正极放出的气体一定为11.2 L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳足量,反应C(s)+H2O(g)![]() CO(g)+H2(g)在一个可变容积的密闭容器中进行,下列条件的改变对其反应速率几乎无影响的是
CO(g)+H2(g)在一个可变容积的密闭容器中进行,下列条件的改变对其反应速率几乎无影响的是
①增加碳的量且表面积保持不变 ②将容器的体积缩小一半 ③保持体积不变,充入He,使体系压强增大 ④保持压强不变,充入He使容器体积变大
A.①④B.②③C.①③D.②④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Li是最轻的固体金属,采用Li作为负极材料的电池具有小而轻、能量密度大等优良性能,得到广泛应用。回答下列问题:
(1)下列Li原子电子排布图表示的状态中,能量最低和最高的分别为_____、_____(填标号)。
A.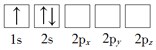 B.
B.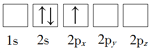
C.![]() D.
D.![]()
(2)Li+与H具有相同的电子构型,r(Li+)小于r(H),原因是______。
(3)LiAlH4是有机合成中常用的还原剂,LiAlH4中的阴离子空间构型是______、中心原子的杂化形式为______。LiAlH4中,存在_____(填标号)。
A.离子键 B.σ键 C.π键 D.氢键
(4)Li2O是离子晶体,其晶格能可通过图(a)的BornHaber循环计算得到。
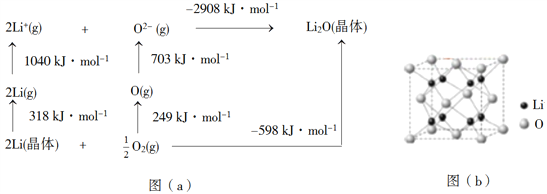
可知,Li原子的第一电离能为________kJ·mol1,O=O键键能为______kJ·mol1,Li2O晶格能为______kJ·mol1。
(5)Li2O具有反萤石结构,晶胞如图(b)所示。已知晶胞参数为0.4665 nm,阿伏加德罗常数的值为NA,则Li2O的密度为______g·cm3(列出计算式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨硼烷(NH3·BH3)电池可在常温下工作,装置如图所示。未加入氨硼烷之前,两极室质量相等,电池反应为NH3·BH3+3H2O2==NH4BO2+4H2O 。已知H2O2足量,下列说法正确的是( )

A. 正极的电极反应式为2H++2e-===H2↑
B. 电池工作时,H+通过质子交换膜向负极移动
C. 电池工作时,正、负极分别放出H2和NH3
D. 工作足够长时间后,若左右两极室质量差为1.9 g,则电路中转移0.6 mol电子
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com