
| A. | H、D、T互为同素异形体 | B. | 质量数为31的磷原子:${\;}_{15}^{31}$P | ||
| C. | 次氯酸的电子式: | D. | 乙烯的结构简式是:CH2CH2 |
分析 A.同种元素组成的不同单质为元素的同素异形体;
B.原子符号表示方法是把质量数标在元素符号左上角,质子数标在左下角,核电荷数=原子序数=质子数;
C.次氯酸中不存在氢氯键,其分子中存在1个氧氢键和1个氧氯键;
D.乙烯的结构简式中需要写出官能团.
解答 解:A、同素异形体研究的对象是单质,H、D、T是氢元素的不同核素,互为同位素,故A错误;
B.质量数为31的磷原子质子数为15,原子符号为:${\;}_{15}^{31}$P,故B正确;
C.次氯酸为共价化合物,分子中不存在氢氯键,次氯酸的电子式为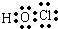 ,故C错误;
,故C错误;
D.乙烯的结构简式是CH2 =CH2,故D错误;
故选B.
点评 本题考查分子结构、常用化学用语书写、同素异形体、同位素等,题目难度中等,旨在考查学生对基础知识的掌握,注意次氯酸电子式的书写.


 科学实验活动册系列答案
科学实验活动册系列答案科目:高中化学 来源: 题型:选择题
 在25℃时,将 1.0L wmoI/L CH3COOH 溶液与 0.1mol NaOH固体混合,充分反应.然后向混合液中加入CH3COOH或CH3COONa固体(忽略体积和温度变化),引起溶液pH的变化如图所示. 下列叙述正确的是( )
在25℃时,将 1.0L wmoI/L CH3COOH 溶液与 0.1mol NaOH固体混合,充分反应.然后向混合液中加入CH3COOH或CH3COONa固体(忽略体积和温度变化),引起溶液pH的变化如图所示. 下列叙述正确的是( )| A. | a、b、c对应的混合液中,水的电离程度由大到小的顺序是c>a>b | |
| B. | b点混合液中 c(Na+)>c(CH3COO-) | |
| C. | 加入CH3COOH过程中,$\frac{c(N{a}^{+})•c(O{H}^{-})}{c(C{H}_{3}CO{O}^{-})}$增大 | |
| D. | 25℃时,CH3COOH的电离平衡常数Ka=$\frac{0.2×1{0}^{-7}}{w-0.1}$mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ,与CO互为等电子体且带1个单位负电荷的阴离子化学式为CN-.
,与CO互为等电子体且带1个单位负电荷的阴离子化学式为CN-.
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 0.10mol•L-1的稀醋酸中存在着平衡:CH3COOH?CH3COOˉ+H+.
0.10mol•L-1的稀醋酸中存在着平衡:CH3COOH?CH3COOˉ+H+.| 醋酸浓度(mol•L-1) | 1 | 0.1 | 0.01 |
| pH值 | 2.50 | 3.00 | 3.50 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题

| A. | 当溶液pH=7时:c(NH4+)>c(H2CO3)+2c(CO32-) | |
| B. | 当溶液pH=9.5时:c(OH-)-c(H+)>c(NH4+)-3c(CO32-) | |
| C. | 若刚好是(NH4)2CO3溶液:c(OH-)+C(NH3•H2O)>c(H+)+c(H2CO3)+c(HCO3-) | |
| D. | 若刚好是NH4HCO3溶液,向其中加入等体积、等物质的量浓度的NaCl溶液,析出部分晶体,过滤所得的滤液中:c(Na+)=c(Cl-)>c(NH4+)>c(HCO3-)>c(CO32-) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:实验题

| 试验编号 | 实验操作 | 现象 |
| a | 向10mL 3mol•L-1KNO3酸性溶液(pH=1)中插入一根洁净的银丝,并滴加氯化钠溶液 | 无沉淀生成 |
| b | 向10mL 3mol•L-1AgNO3溶液中滴加2mL 0.1mol•L-1FeSO4溶液,振荡;再滴加酸性高锰酸钾溶液 | 紫红色溶液不褪色 |
| c | 向10mL 3mol•L-1Fe(NO3)3溶液(pH=1)中插入一根洁净的银丝,并滴加氯化钠溶液 | 产生白色沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 化学式 | AgCl | Ag2CrO4 | CH3COOH | HClO | H2CO3 |
| Ksp或Ka | Ksp=1.8×10-10 | Ksp=2×10-12 | Ka=1.8×10-5 | Ka=3.0×10-8 | Ka1=4.1×10-7 Ka2=5.6×10-11 |
| A. | 相同浓度CH3COONa和NaClO的混合液中,各离子浓度的大小关系是:c(Na+)>c(ClO-)>c(CH3COO-)>c(OH-)>c(H+) | |
| B. | 向0.1mol•L-1CH3COOH溶液中滴加NaOH溶液至c(CH3COOH):c(CH3COO-)=9:5,此时溶液pH=5 | |
| C. | 碳酸钠溶液中滴加少量氯水的离子方程式是2CO32-+Cl2+H2O═2HCO3-+Cl-+ClO- | |
| D. | 向浓度均为1×10-3mol•L-1的KCl和K2CrO4混合液中滴加1×10-3mol•L-1的AgNO3溶液,CrO42-先形成沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com