
| A. | 工业上用水吸收NO2生产硝酸:3NO2+H2O=2HNO3+NO | |
| B. | 用氨水除去工业原料氯化铵中的氯化铁杂质:Fe3++3OH-=Fe(OH)3↓ | |
| C. | 用熟石灰处理泄漏的液氯:2Ca(OH)2+2Cl2=CaCl2+Ca(ClO)2+2H2O | |
| D. | 用明矾除去水中的悬浮颗粒物:Al3++3H2O?Al(OH)3(胶体)+3H+ |
分析 A.二氧化氮与水反应生成硝酸和NO气体;
B.一水合氨不能拆开,需要保留分子式;
C.氯气能够与氢氧化钙反应生成氯化钙、次氯酸钙和水;
D.铝离子水解生成氢氧化铝胶体,氢氧化铝胶体具有较大的表面积,能够净水.
解答 解:A.工业上用水吸收NO2生产硝酸,反应的化学方程式为3NO2+H2O=2HNO3+NO,故A正确;
B.用氨水除去工业原料氯化铵中的氯化铁杂质,反应生成氢氧化铁沉淀和氯化铵,正确的离子方程式为Fe3++3NH3•H2O=Fe(OH)3↓+3NH4+,故B错误;
C.用熟石灰处理泄漏的液氯,氢氧化钙与氯气反应生成氯化钙、次氯酸钙和水,反应的化学方程式为2Ca(OH)2+2Cl2=CaCl2+Ca(ClO)2+2H2O,故C正确;
D.明矾除去水中的悬浮颗粒物,铝离子能够水解生成氢氧化铝胶体,反应的离子方程式为Al3++3H2O?Al(OH)3(胶体)+3H+,故D正确;
故选B.
点评 本题考查了化学方程式、离子方程式的书写判断,题目难度中等,注意掌握离子方程式、化学方程式的书写原则,B为易错点,注意一水合氨为弱电解质,离子方程式中不能拆开.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
| 实验 编号 | T/℃ | 大理石 规格 | HNO3浓度 (mol?L-1) | 实验目的 |
| ① | 25 | 粗颗粒 | 2.00 | (Ⅰ)实验①和②探究HNO3浓度对该反应速率的影响; (Ⅱ)实验①和③探究温度对该反应速率的影响; (Ⅲ)实验①和④探究大理石规格(粗、细)对该反应速率的影响; |
| ② | ||||
| ③ | 粗颗粒 | 2.00 | ||
| ④ | 25 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 凡是分子组成相差一个或几个CH2原子团的物质,彼此一定是同系物 | |
| B. | 两种化合物组成元素相同,各元素质量分数也相同,则两者一定是同分异构体 | |
| C. | 相对分子质量相同的几种化合物,互称为同分异构体 | |
| D. | 组成元素的质量分数相同,且相对分子质量也相同的不同化合物,一定互为同分异构体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 将0.40mol N2O4气体充入2L固定容积的密闭容器中发生如下反应:N2O4(g)?2NO2(g)△H.在Tl℃和T2℃时,测得NO2的物质的量随时间变化如图所示:
将0.40mol N2O4气体充入2L固定容积的密闭容器中发生如下反应:N2O4(g)?2NO2(g)△H.在Tl℃和T2℃时,测得NO2的物质的量随时间变化如图所示:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向盛有少量Mg(OH)2沉淀的试管中滴加适量NH4Cl溶液,沉淀溶解:Mg(OH)2+2NH4+=2NH3•H2O+Mg2+ | |
| B. | SO2通入澄清石灰水中,产生白色沉淀:SO2+Ca2++2OH-=CaSO4↓+H2O | |
| C. | 向Ca(HCO3)2溶液中加入过量NaOH溶液,有白色沉淀生成:Ca2++2HCO3-+2OH-═CaCO3↓+CO32-+2H2O | |
| D. | 长期过量服用阿司匹林出现水杨酸(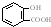 )反应,可静脉注滴NaHCO3溶液: )反应,可静脉注滴NaHCO3溶液: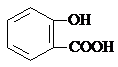 +HCO3-→ +HCO3-→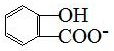 +CO2↑+H2O +CO2↑+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 实验及现象 | 能量关系 | |
| A | 将“NO2球”置于热水中,红棕色加深 | N2O4(g)?2NO2(g)△H<0 |
| B | NaOH与HCl溶液混合,溶液温度升高 |  |
| C | 钠投入水中,熔化成小球 |  |
| D | 微热含酚酞的Na2CO3溶液,红色加深 | CO32-(aq)+H2O(l)?HCO3-(aq)+OH-(aq)△H<0 |
| A. | A、 | B. | B、 | C. | C、 | D. | D、 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
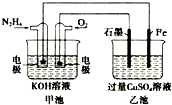
| A. | 甲池中负极上的电极反应式为N2H4-4e-=N2+4H+ | |
| B. | 乙池中石墨电极上发生的反应为4OH--4e-=2H2O+O2↑ | |
| C. | 甲池溶液pH增大,乙池溶液pH减小 | |
| D. | 甲池中每消耗0.1mol N2H4乙池电极上则会析出6.4g固体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ④ | ⑤ | ⑥ | ⑨ | ||||
| 3 | ① | ② | ③ | ⑦ | ⑧ |
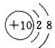 .
.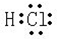 ,
,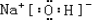 ,所含有的化学键类型有离子键、极性共价键,(请选择“离子键”、“极性共价键”、“非极性共价键”中的一个或几个填写).
,所含有的化学键类型有离子键、极性共价键,(请选择“离子键”、“极性共价键”、“非极性共价键”中的一个或几个填写).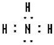 ,其水溶液的pH>7(填“<”或“>”).
,其水溶液的pH>7(填“<”或“>”).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
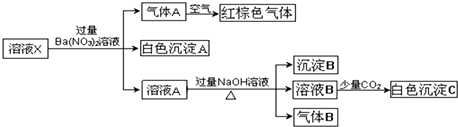
| A. | 原溶液中可能含有NO3-和Al3+ | |
| B. | 白色沉淀C可能是Al(OH)3 | |
| C. | 原溶液中一定存在NH4+、Fe2+、SO42-、Cl- | |
| D. | 沉淀B可能是Fe(OH)2和Fe(OH)3的混合物 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com