
����Ŀ������һƿ��ǩ��ע��Ϊ���������εĸ��ϼ������ܺ����ơ�þ���ơ�����Ԫ�أ�ijͬѧΪ��ȷ�����еĽ���Ԫ�أ�ȡ���ָ��Ƽ���Ϊ��Һ����������ʵ�飮��֪����ҺpH=4ʱ��Fe3+������ȫ��Ca2+��Mg2+��������
��ش��������⣺
��1����������1����ܡ����ܡ���ȷ������Һ�к���Na+ ��
��2������3�а�ɫ�����Ļ�ѧʽ�� ��
��3����ҺA�м���H2O2��Һ��Ŀ���� ��
��4����������ʵ�飬�����ƶϳ������������εĸ��ϼ���һ�����е�Ԫ���� �� һ�������е�Ԫ���� ��
���𰸡�
��1������
��2��CaCO3
��3����Fe2+����ΪFe3+ �� ���ڼ���
��4��Ca��Fe��Mg
���������⣺��1���������NaOH ��aq����Na2CO3��aq��������Һ��������Na+ �� ���ܸ�����Һ��ɫ��Ӧ�Ļ�ɫ�����ж���Һ�Ƿ�Na+ �� ���Դ��ǣ����ܣ���2�����ݡ�������ҺpH=4ʱ��Fe��OH��3������ȫ��Ca2+��Mg2+����������Ϣ���ڹ��˳�ȥFe��OH��3����Һ�зֱ����NH3H2O��aq����Na2CO3��aq��������NH3H2O��aq������������˵����Һ�в���Mg2+ �� ����Na2CO3 ��aq��������ɫ������˵����Һ�к�Ca2+ �� ����3�а�ɫ�����Ļ�ѧʽ��CaCO3 �� ���Դ��ǣ�CaCO3����3����Һ����H2O2�����������ܱ�˫��ˮ����Ϊ�����ӣ����ڼ��飬�����ķ�ӦΪ2Fe2++H2O2+2H+�T2Fe3++2H2O�����Դ��ǣ���Fe2+����ΪFe3+ �� ���ڼ��飻��4����Һ����H2O2�����������ܱ�˫��ˮ����Ϊ�����ӣ����ݡ�������ҺpH=4ʱ��Fe��OH��3������ȫ��Ca2+��Mg2+����������Ϣ���ڹ��˳�ȥFe��OH��3����Һ�зֱ����NH3H2O��aq����Na2CO3��aq��������NH3H2O��aq������������˵����Һ�в���Mg2+ �� ����Na2CO3 ��aq��������ɫ������˵����Һ�к�Ca2+ �� ���Դ��ǣ�Ca��Fe��Mg��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������Ѱ�ҵ�ĸ���ƷFeSO4����TiO2+��Al3+������������ؼ��ߴ���ϸ�����������乤���������£�
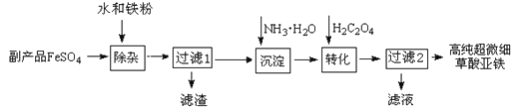
��֪��
�ٹ���1�õ�����������Ҫ�ɷ���Al(OH)3��H2TiO3
��5Fe2+ +MnO4- +8H+ =5Fe3+ +Mn2+ +4H2O 5C2O42- +2MnO4- +16H+ =10CO2��+2Mn2+ +8H2O
��1�����ӹ����м���Fe��������___________________________��
��2���������̵ķ�Ӧ�¶�Ϊ40�棬�¶Ȳ��˹��ߵ�ԭ����˿��Ƴ����������⣬����_____��
��3��ʵ���Ҳⶨ�ߴ���ϸ����������ɵIJ�������Ϊ��
����1��ȷ����һ��������������Ʒ������30 mL 2mol��L-1 ��H2SO4�ܽ⡣
����2����c mol��L-1��KMnO4��Һ�ζ������������a mL��
����3����ζ������Һ�м���3g Zn�ۺ�8 mL 2mol��L-1��H2SO4��Һ����Fe3+��ԭΪFe2+��
����4�����ˣ���Һ��������KMnO4��Һ�ζ���������Һb mL��
�� KMnO4��ҺӦ��װ��_______________�ζ����С�
�� ��KMnO4��Һ�ζ�����Һ���ﵽ�ζ��յ�ı�־��__________________________________��
�� ���в����ᵼ�²ⶨ�������Ʒ��C2O42- �����ʵ���ƫ�����____________________
A. ����2�У��ζ���δ�ñ�KMnO4 ��Һ��ϴ
B. ����3���Zn����
C. ����2�У�������Һ���ʱ�������Ӻ���
D. ����4�У�������Һ���ʱ���ȸ��Ӻ�����
�� ��Ʒ��C2O42- �����ʵ���Ϊ_______________________��
��4����һ�������������Һ���ữ�IJ���������Һ��ϣ���÷�ӦҺ��Mn2+ ��Ũ���淴Ӧʱ��t�ı仯����ͼ����仯���Ƶ�ԭ�����Ϊ__________________________________��

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ڷ�Ӧ3Cl2+6NaOH ![]() 5NaCl+NaClO3+3H2O������������ȷ���ǣ� ��
5NaCl+NaClO3+3H2O������������ȷ���ǣ� ��
A.Cl2����������NaOH�ǻ�ԭ��
B.����������ԭ�Ӻͱ���ԭ����ԭ�ӵ����ʵ���֮��Ϊ5��1
C.Cl2����������������ԭ��
D.�������õ������뻹ԭ��ʧ������֮��Ϊ5��1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ���¶��£���4molPCl3��2molCl2�����ݻ�������ܱ������У���һ�������·�Ӧ��PCl3+Cl2PCl5 �� �����ʾ�Ϊ��̬����ƽ���PCl5Ϊ0.8mol������ʱ������2molPCl3��1molCl2 �� ��ͬ�¶��´ﵽƽ�⣬PCl5�����ʵ���Ϊ�� ��
A.0.8mol
B.0.4mol
C.0.4mol��x��0.8mol
D.��0.4mol
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ϲ��뺣�����ƣ���һ�ָ��������ĺ���ֲ���Ʒ�ϲ��ᱡ�ɴࡢ�Ⱥ������ױ����ճɻ�ʵ��������ϲ�����ȡ���������ͼ1�� 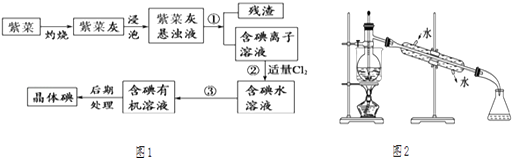
��1��ʵ���ұ����ϲˣ���Ҫ���������е�������ţ���
a���Թ� b���ձ� c������ d�������� e�������ż� f���ƾ���
��2��ָ����ȡ��Ĺ������йص�ʵ��������ƣ��� �� �� ��
��3����ȡ��Ĺ����У���ѡ����л��Լ���
A���ƾ� B���� C������ D��ʳ��ˮ
ѡ����Լ��������� ��
��4��Ϊʹ�ϲ˻��е�����ת��Ϊ����л���Һ��ʵ�������ձ���������������ƿ���ƾ��ơ����ܡ�Բ����ƿ��ʯ�����Լ���Ҫ�ļг���������Ʒ����ȱ�ٵIJ����������� ��
��5���Ӻ�����л���Һ����ȡ��ͻ����л��ܼ������뾭�����۲�ͼ2�е�ʵ��װ��ͼ�������еĴ���֮����
���������� ��
��6�����������������ʱ��ʹ��ˮԡ���ȣ����̬������ۼ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����Ȼ�������ɫҺ�壬�۵㩁33�棬�е�114�森������������ڼ���ʱ��Ӧ���������Ʊ�SnCl4 �� SnCl4����ˮ�⣬�ڳ�ʪ�Ŀ����з��̣�ʵ���ҿ���ͨ��ͼװ���Ʊ�����SnCl4 ���г�װ���ԣ��� 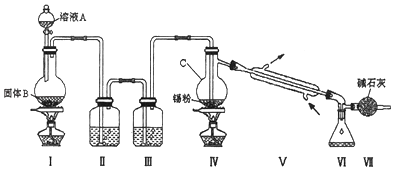
��1������C����������
��2��װ�â��з�����Ӧ�����ӷ���ʽΪ����
��3��װ�â��е�����Լ�Ϊ �� װ�â�������Ϊ��
��4����װ������˳��Ϊ��һ��һ��һ��һ�����ڢ��г�����SnCl4�⣬�������ɵĺ����Ļ�����Ļ�ѧʽΪ ��
��5�����м��ȵ�����֮һ�Ǵٽ����������۷�Ӧ�����ȵ���һ����Ϊ��
��6����������ȥ����11.9g����Ӧ������ƿ���ռ���23.8g SnCl4 �� ��SnCl4�IJ���Ϊ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ���¶��£�������X������Y��0.16mol���� 10L�����ܱ������У�������ӦX��g��+Y��g��2Z��g����H��0��һ��ʱ���ﵽƽ�⣮��Ӧ�����вⶨ���������±�������˵����ȷ���ǣ� ��
t/min | 2 | 4 | 7 | 9 |
n��Y��/mol | 0.12 | 0.11 | 0.10 | 0.10 |
A.��Ӧǰ2min��ƽ������v��Z��=4.0��10��3mol/��Lmin��
B.�����������䣬�����¶ȣ���Ӧ�ﵽ��ƽ��ǰv���棩��v������
C.���¶��´˷�Ӧ��ƽ�ⳣ��K=1.44
D.�����������䣬�ٳ���0.2molZ��ƽ��ʱX�������������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����й����л��������˵����ȷ����(����)
A.�Ҵ������ᶼ����̼��˫��
B.�������ϩ��������������Ӧ
C.���Ը�����ؿ�������������ȩ
D.��ϩ���������������ӳɷ�Ӧ�����������������ӳ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����NA��ʾ�����ӵ�������ֵ��������������ȷ���ǣ� ��
A.0.5mol�ۻƣ�As4S4 �� �ṹ��ͼ������NA��S��S�� 
B.1mol/L��NH4��2SO4��Һ�У���SO42��NA����NH4+����2NA��
C.23g����һ�������������ã������߾���ʣ�࣬ת��NA������
D.����0.1 mol FeCl3����Һ�μӵ���ˮ����ȫˮ�������0.1 NA��Fe��OH��3����
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com