
| A. | 131是这种碘-131的质量数 | B. | $\underset{131}{53}$I与$\underset{127}{53}$I互为同位素 | ||
| C. | 碘-131的中子数为53 | D. | 碘元素在周期表中位于第ⅦA族 |
分析 A.元素符号的左上角为质量数;
B.质子数相同,而中子数不同的原子互为同位素;
C.中子数=质量数-质子数;
D.根据原子序数判断碘在周期表中位置.
解答 解:A.131是碘-131的质量数,故A正确;
B.$\underset{131}{53}$I与$\underset{127}{53}$I质子数相同,中子数不同,互为同位素,故B正确;
C.碘的质子数为53,所以131I原子的中子数=131-53=78,故C错误;
D.碘是元素周期表中53号元素,常用周期表中第五周期第ⅦA族,故D正确.
故选C.
点评 本题考查原子构成、原子结构与位置关系、同位素等,比较基础,注意原子结构与位置关系.


科目:高中化学 来源: 题型:选择题
| A. | Ba2+(aq)+SO42-(aq)═BaSO4(s)△H=-2.92kJ•mol-1 | |
| B. | Ba2+(aq)+SO42-(aq)═BaSO4(s)△H=-18kJ•mol-1 | |
| C. | Ba2+(aq)+SO42-(aq)═BaSO4(s)△H=-73kJ•mol-1 | |
| D. | Ba2+(aq)+SO42-(aq)═BaSO4(s)△H=-0.72kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NO2、SO2、BF2、NCl3分子中没有一个分子中原子的最外层电子都满足了8e-稳定结构 | |
| B. | CCl4和NH3都是以极性键结合的极性分子,P4和NO2都是共价化合物 | |
| C. | 在CaO和SiO2晶体中,都不存在单个小分子 | |
| D. | π键是由两个p电子“头碰头”重叠形成,σ键是镜面对称,而π键是轴对称 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向鸡蛋白溶液中加浓(NH4)2SO4溶液,有沉淀析出,再加足量的水,沉淀不溶解 | |
| B. | 将SO2通入酸性KMnO4溶液中,溶液褪色,证明SO2具有漂白性 | |
| C. | 取样灼烧,可以鉴别某白色纺织品是棉纺织品还是羊毛制品 | |
| D. | 向新制的Na2S溶液中滴加氨水产生淡黄色沉淀,可证明非金属性S>Cl |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向NH4Al(SO4)2溶液中滴入Ba(OH)2溶液至SO42-恰好沉淀完全:2Ba2++4OH-+Al3++2SO42-═2BaSO4↓+AlO2-+2H2O | |
| B. | 将标准状况下1.12L氯气通入10mL 1mol•L-1的溴化亚铁溶液中:2Fe2++2Br-+2Cl2=2Fe3++4Cl-+Br2 | |
| C. | 氢氧化铁溶于氢碘酸溶液:2Fe(OH)3+6H++2I-═2Fe2++I2+6H2O | |
| D. | 4mol•L-1的NaAlO2溶液和7mol•L-1的盐酸等体积混合:AlO2-+4H+=Al3++2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
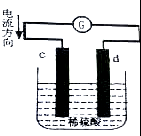 如图是锌片和铜片同时插入稀硫酸中所组成的原电池装置,c,d为两个电极.则下列有关的判断不正确的是( )
如图是锌片和铜片同时插入稀硫酸中所组成的原电池装置,c,d为两个电极.则下列有关的判断不正确的是( )| A. | d为负极,电池工作时,d极发生氧化反应 | |
| B. | c为锌片,电池工作时,溶液中SO42-向c极移动 | |
| C. | 电池工作的过程中,d电极上产生大量的气泡 | |
| D. | 电池工作的过程中,溶液的pH基本不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下,CH3COONa和CH3COOH混合溶液中[pH=7,c(Na+)=0.1mol•L-1]:c(Na+)=c(CH3COO-)>c(H+)=c(OH-) | |
| B. | 在O.1mol•L-1Na2C03溶液中:cc(Na+)=2c(CO32-) | |
| C. | 在O.1mol•L-1NaHC03溶液中:c(HCO3-)>c(CO32-)>c(H2C03) | |
| D. | 向0.2mol•L-1NaHC03溶液中加入等体积O.1mol•L-1NaOH溶液:c(CO32-)+c(HCO3-)+c(OH-)=c(H+)+c(Na+) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com