
下列各组物质中,物质之间通过一步反应就能实现图示转化的是

A.①②③ B.①③④ C.①④ D.②④
C
【解析】
试题分析:① 2FeCl2+Cl2=2FeCl3;2FeCl3+Cu=CuCl2+2FeCl2;CuCl2+Fe=Cu+ FeCl2;Fe+2HCl=FeCl2+H2↑,2Fe+3Cl2 2FeCl3,正确;②2Na2O+O2
2FeCl3,正确;②2Na2O+O2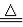 2Na2O2;2Na2O2+2CO2=2Na2CO3+O2;Na2CO3不能一步转化为Na2O;2Na+O2
2Na2O2;2Na2O2+2CO2=2Na2CO3+O2;Na2CO3不能一步转化为Na2O;2Na+O2 Na2O2;4Na+O2=2Na2O,错误;③2NO+O2=2NO2,3NO2+H2O=HNO3+NO;8HNO3(稀)+3Cu=3Cu(NO3)2+2NO↑+4H2O;N2+O2
Na2O2;4Na+O2=2Na2O,错误;③2NO+O2=2NO2,3NO2+H2O=HNO3+NO;8HNO3(稀)+3Cu=3Cu(NO3)2+2NO↑+4H2O;N2+O2 2NO,但是不能反应产生NO2,错误;④Al2O3+2NaOH+3H2O=2Na[Al(OH)4],Na[Al(OH)4]+HCl=Al(OH)3↓+NaCl+H2O,2Al(OH)3
2NO,但是不能反应产生NO2,错误;④Al2O3+2NaOH+3H2O=2Na[Al(OH)4],Na[Al(OH)4]+HCl=Al(OH)3↓+NaCl+H2O,2Al(OH)3 Al2O3+ 3H2O,4Al+3O2
Al2O3+ 3H2O,4Al+3O2 2Al2O3;2Al+2NaOH+6H2O=2Na[Al(OH)4]+3H2↑;正确。因此物质之间通过一步反应就能实现图示转化的是①④。选项是C。
2Al2O3;2Al+2NaOH+6H2O=2Na[Al(OH)4]+3H2↑;正确。因此物质之间通过一步反应就能实现图示转化的是①④。选项是C。
考点:考查物质的化学性质及相互转化的关系的知识。


科目:高中化学 来源:2014-2015江苏省泰州市姜堰区高一上学期期末化学试卷(解析版) 题型:选择题
生产、生活中离不开各类化学物质,下列化学物质中属于盐类的是
A.胆矾 B.金刚石 C.水晶 D.苛性钠
查看答案和解析>>
科目:高中化学 来源:2014-2015学年山东省菏泽市高三上学期期末考试化学B试卷(解析版) 题型:填空题
(10分)氯化铁是常见的水处理剂,工业上制备无水FeCl3的一种工艺如下:

(1)试写出吸收塔中吸收剂Q(FeCl2)反应的离子方程式: 。
(2)六水合氯化铁在水中的溶解度如下:
温度/℃ | 0 | 10 | 20 | 30 | 50 | 80 | 100 |
溶解度(g/100gH2O) | 74.4 | 81.9 | 91.8 | 106.8 | 315.1 | 525.8 | 535.7 |
从FeCl3溶液制得FeCl3·6H2O晶体的操作步骤是:加入少量盐酸、 、 、过滤、洗涤、干燥。
(3)常温下,若溶液的pH控制不当会使Fe3+沉淀,pH=4时,溶液中c(Fe3+)= mol·L-1。(常温下Ksp[Fe(OH)3]=2.6×10-39)。
(4)FeCl3的质量分数通常可用碘量法测定:称取mg无水氯化铁样品,溶于稀盐酸,再转移到100mL容量瓶,用蒸馏水定容;取出10.00mL,加入稍过量的KI溶液,充分反应后,滴入淀粉指示剂并用c mol·L―1 Na2S2O3溶液滴定用去V mL。
(已知:I2+2S2O32-=2I-+S4O62-)
①滴定终点的现象是: 。
②样品中氯化铁的质量分数为 (用字母m、C、V来表示)。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年山东省菏泽市高三上学期期末考试化学B试卷(解析版) 题型:选择题
NA表示阿伏加德罗常数,下列叙述正确的是
A.1 L 1 mol·L-1的NaClO溶液中含有ClO-的数目为NA。
B.标准状况下,0.1 mol Cl2溶于水,转移电子的数目为0.1 NA。
C.2.3 g Na与O2完全反应生成3.6 g产物时失电子数是0.1×6.02×1023
D.标准状况下,11.2 L CH3CH2OH中含有的分子数为0.5NA
查看答案和解析>>
科目:高中化学 来源:2014-2015学年山东省德州市高三2月期末统考化学试卷(解析版) 题型:填空题
(15分)运用化学反应原理分析解答以下问题
(1)250℃时,以镍合金为催化剂,向4L容器中通人6 mol CO2、6 molCH4 ,发生如下反应:CO2(g)+CH4(g)  2CO(g)+2H2(g)。平衡体系中各组分体积分数如下表:
2CO(g)+2H2(g)。平衡体系中各组分体积分数如下表:
物质 | CH4 | CO2 | CO | H2 |
体积分数 | 0.1 | 0.1 | 0.4 | 0.4 |
①此温度下该反应的平衡常数K=___________.
②若再向容器中同时充入2.0molCO2、6.0 molCH4 、4.0 molCO和8.0 molH2 ,则上述平衡向_____(填“正反应”或“逆反应”)方向移动。
,则上述平衡向_____(填“正反应”或“逆反应”)方向移动。
(2)硝化法是 一种古老的生产硫酸的方法,同时实现了氮氧化物的循环转化,主要反应为:
一种古老的生产硫酸的方法,同时实现了氮氧化物的循环转化,主要反应为:
已知:① NO2(g)+SO2(g)  SO3(g)+NO(g) ΔH= —41.8KJ·mol-1
SO3(g)+NO(g) ΔH= —41.8KJ·mol-1
②2SO2(g)+O2(g)  2SO3(g) ΔH= —196.6KJ·mol-1
2SO3(g) ΔH= —196.6KJ·mol-1
①写出NO和O2反应生成NO2的热化学方程式__________。
②一定温度下,向2L恒容密闭容器中充人NO2和SO2各1 mol,5min达到平衡,此时容器中NO和NO2的浓度之比为3:1,则NO2的平衡转化率是_________。
(3)常温下有浓度均为0.1 mol/L的四种溶液:①Na2CO3、②NaHCO3、③HCl、④NH3.H2O。
①有人称溶液①是油污的“清道夫”,原因是_________(用离子方程式解释)
②上述溶液中,既能与氢氧化钠反应,又能和硫酸反应的溶液中离子浓度由大到小的顺序为__________。
③向④中加入少量氯化铵固体,此时c(NH4+)/ c(OH-)的值_________(填“ 增大”“减小”或“不变”)。 ④若将③和④的溶液混合后溶液恰好呈中性,则混合前③的体积_________④的体积(填“大于”小于”或“等于”)
增大”“减小”或“不变”)。 ④若将③和④的溶液混合后溶液恰好呈中性,则混合前③的体积_________④的体积(填“大于”小于”或“等于”)
⑤将10 mL溶液③加水稀释至100 mL,则 此时溶液中由水电离出的c( H+)=___________。
此时溶液中由水电离出的c( H+)=___________。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年山东省德州市高三2月期末统考化学试卷(解析版) 题型:选择题
下列说法正确的是
A.放热反应的反应速率一定大于吸热反应的反应速率
B.熔融状态下能导电的化合物一定含离子键
C.增大反应物浓度可加快反应速率,因此可用浓硫酸与 铁反应增大生成氢气的速率
铁反应增大生成氢气的速率
D.在海轮外壳连接锌块保护外壳不受腐蚀是采用了牺牲阴极的阳极保护法
查看答案和解析>>
科目:高中化学 来源:2014-2015学年江苏省泰州市姜堰区高三下学期期初联考化学试卷(解析版) 题型:填空题
(12分)前四周期元素A、B、C、D、E原子序数依次增大,A是周期表所有原子中原子半径最小的,B有三个能级,且各个能级上电子数相等,D与C同周期,且C中未成对电子是该周期中最多的;D基态原子的2p电子是2s电子的2倍;E有4个电子层,且与A最外层电子数相同,其他各层均排满。
(1)写出E2+的基态核外电子排布式 。
(2)A和C可以形成18电子的分子,该分子中C原子的杂化方式为 。
(3)C与D形成的酸根离子CD3-
①CD3-的空间构型为 (用文字描述)。
②写出一种与CD3-互为等电子体的分子的化学式 。
(4)CA3的沸点比BA4的沸点高的原因是 。
(5)E2+与C的常见氢化物形成配位数为4的配合物离子,1mol该离子中含σ键数目为 。
(6)E晶胞结构如图所示,该晶体中每个E原子周围距离最近的E原子数目为 。

查看答案和解析>>
科目:高中化学 来源:2014-2015学年江苏省泰州市姜堰区高三下学期期初联考化学试卷(解析版) 题型:选择题
下列物质性质与应用对应关系均正确的是
A.SO2具有漂白性,可用SO2加工银耳,使之更白
B.炭具有强还原性,常用于冶炼镁、钠等金属
C.淀粉遇碘变蓝色,常用于检验食盐是否为加碘盐
D.NaHCO3可以与胃酸反应,可用NaHCO3治疗胃酸过多
查看答案和解析>>
科目:高中化学 来源:2014-2015学年湖北省八市高三年级三月联考理综化学试卷(解析版) 题型:选择题
化学与生产和生活、军事、科研产品紧密相关,下列说法错误的是
A.家庭用的“84”消毒液与洁厕灵不能同时混合使用,否则会发生中毒事故
B.在牙膏中添入Na2PO3F、NaF能防治龋齿,当提供的氟离子浓度相等时,它们防治龋齿的作用是相同的
C.侯氏制碱法的工艺过程中主要应用了物质熔沸点的差异
D.可用蘸浓盐酸的玻璃棒检验输送氨气的管道是否漏气
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com