
下列说法正确的是( )
|
| A. | 增大压强,活化分子数增加,化学反应速率一定增大 |
|
| B. | 升高温度,活化分子百分数增加,化学反应速率一定增大 |
|
| C. | 活化分子间所发生的分子间的碰撞为有效碰撞 |
|
| D. | 加入反应物,使活化分子百分数增加,化学反应速率增大 |
考点:
化学反应速率的影响因素.
专题:
化学反应速率专题.
分析:
A、增大压强,使浓度增大,活化分子百分数增加;
B、升高温度,活化分子百分数增加,化学反应速率增大;
C、活化分子间所发生的分子间的碰撞,只有能发生反应的碰撞才是有效碰撞;
D、加入反应物,活化分子百分数不变.
解答:
解:A、增大压强,使浓度增大,活化分子浓度增加,化学反应素速率增大,故A错误;
B、升高温度,活化分子百分数增加,化学反应速率一定能够增大,故B正确;
C、活化分子间所发生的分子间的碰撞,只有能发生反应的碰撞才是有效碰撞,故C错误;
D、加入反应物,活化分子百分数不变,但活化分子总数增加,化学反应速率增大,故D错误.
故选B.
点评:
本题考查学生影响化学反应速率的因素中的温度、浓度因素,可以根据所学知识进行回答,难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
某一有机物A(C6H12O2)可发生下列变化: 已知C为羧酸,且B不发生银镜反应,E能发生银镜反应,则A的可能结构有()
已知C为羧酸,且B不发生银镜反应,E能发生银镜反应,则A的可能结构有()
A. 6种 B. 8种 C. 9种 D. 13种
查看答案和解析>>
科目:高中化学 来源: 题型:
已知在一定条件下,2SO2+O2⇌2SO3反应达平衡后SO2的转化率为45.3%,加入V2O5(催化剂)后,SO2的转化率为( )
|
| A. | 大于45.3% | B. | 小于45.3% | C. | 等于45.3% | D. | 无法确定 |
查看答案和解析>>
科目:高中化学 来源: 题型:
关于图所示装置(盐桥含KCl)的叙述,正确的是( )
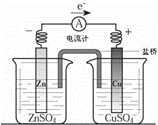
|
| A. | 铜离子在铜片表面被氧化 |
|
| B. | 铜作阳极,铜片上有气泡产生 |
|
| C. | 电流从锌片经导线流向铜片 |
|
| D. | 如图烧杯中,SO42﹣的物质的量几乎不变,K+的数目增多 |
查看答案和解析>>
科目:高中化学 来源: 题型:
在一个固定体积为2升的密闭容器中,充入2mol A和1mol B,发生如下反应:2A(g)+B(g)⇌3C(g)+D(s),2分钟反应达到平衡,此时C的浓度为1.2 mol/L.
(1)2分钟内用B表示的平均反应速度为 ;
(2)若容器温度升高,平衡时混合气体的平均相对摩尔质量减小,则正反应为: (填“吸热”或“放热”)反应.
查看答案和解析>>
科目:高中化学 来源: 题型:
下表列出了a﹣f六种元素在周期表前三周期的位置.
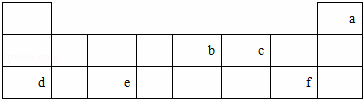
请回答下列问题:
(1)c元素的名称是氧,d元素位于IA族.
(2)用元素符号表示,六种元素中,性质最稳定的元素原子结构示意图 , 元素的原子半径最大.
(3)非金属性b c.(填“大于”“小于”)
(4)用化学式表示,六种元素中,最高价氧化物属于两性氧化物的是 ,最高价氧化物对应水化物酸性最强的是 4
(5)写出d元素单质与水反应的离子方程式
(6)写出e元素单质与NaOH反应的离子方程式
(7)用电子式表示化合物d2c的形成过程 .
查看答案和解析>>
科目:高中化学 来源: 题型:
在容积相同的两密闭容器A和B中,保持温度为150℃,同时向A容器中加入a mol HI,向B容器中加入b mol HI (a>b),当反应2HI (g)⇌H2(g)+I2(g) 达到平衡后,下列说法正确的是()
A. 应开始达到平衡,所需时间tA>tB
B. 平衡时 C(I2)A=C(I2)B
C. 平衡时I2蒸气在混合气体中的体积分数:A>B
D. A与B中HI的平衡分解率相等.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com