
(14分)我国是世界上最大的耗煤国家,但每年占总产量70%的煤都被直接烧掉,既浪费了资源又污染环境。因此开发新能源是国家能源发展的方向。
试回答下列问题:
(1)已知1.12LCH4(标况)完全燃烧生成二氧化碳和液态水,可放出44.5KJ的热量,则其热化学方程式为__________;
(2)人们常用“热值”来衡量燃料燃烧放出的热量的大小。“热值”是指常温常压下,1g物质完全燃烧生成稳定物质放出的热量。则CH4的热值是________KJ.g-1
(3)氢气是一种清洁能源,它不仅热值高,而且原料丰富。氢氧燃料电池是以氢气为燃料,氧气是氧化剂,以氢氧化钾为电解质溶液的燃料电池,试写出正、负极的电极反应式:
正极_______________________ ,负极________________________________.
(4)若以上述氢氧燃料电池作电源,以碳棒为阳极电解100mL饱和食盐水,则阳极的电极反应式为__________________________;当电路中通过0.2mol电子时,阳极可产生的气体____________L(标况下),此时溶液中氢氧化钠的物质的量浓度为________mol.L-1(假设电解前后溶液体积不变).
(1) CH4(g)+2O2(g)=CO2(g)+2H2O(l) △H=-890 KJ.mol-1。
(2) 55.6 (3)O2+4e-+2H2O=4OH-, 2H2-4e-+4OH-=4H2O
(4)2Cl--2e-=Cl2↑;2.24; 2
【解析】(1)考查热化学方程式的书写。1.12LCH4(标况)是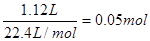 ,所以1mol甲烷燃烧放出的能量是44.5KJ×20=890kJ。
,所以1mol甲烷燃烧放出的能量是44.5KJ×20=890kJ。
(2)1mol甲烷燃烧放出890kJ的能量,所以其热值是 。
。
(3)在燃料电池中可燃物通入负极,失去电子,发生氧化反应。空气或氧气通入正极,得到电子,发生还原反应。
(4)惰性电极电解饱和食盐水时,阳极是氯离子放电,生成氯气,电极反应式为2Cl--2e-=Cl2↑,所以当转移0.2mol电子时,生成0.1mol氯气,标准状况下的体积是2.24L。根据电解的总反应式1NaCl+2H2O 2NaOH+H2↑+Cl2↑可知,氢氧化钠的物质的量是0.2mol,其浓度是
2NaOH+H2↑+Cl2↑可知,氢氧化钠的物质的量是0.2mol,其浓度是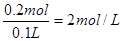 。
。


科目:高中化学 来源:山西省太原五中2011-2012学年高二上学期期末检测化学文科试题 题型:022
| |||||||||||||||||||||||||||
查看答案和解析>>
科目:高中化学 来源: 题型:
(14分)我国是世界上最大的耗煤国家,但每年占总产量70%的煤都被直接烧掉,既浪费了资源又污染环境。因此开发新能源是国家能源发展的方向。
试回答下列问题:
(1)已知1.12LCH4(标况)完全燃烧生成二氧化碳和液态水,可放出44.5KJ的热量,则其热化学方程式为__________;
(2)人们常用“热值”来衡量燃料燃烧放出的热量的大小。“热值”是指常温常压下,1g物质完全燃烧生成稳定物质放出的热量。则CH4的热值是________KJ.g-1
(3)氢气是一种清洁能源,它不仅热值高,而且原料丰富。氢氧燃料电池是以氢气为燃料,氧气是氧化剂,以氢氧化钾为电解质溶液的燃料电池,试写出正、负极的电极反应式:
正极_______________________ ,负极________________________________.
(4)若以上述氢氧燃料电池作电源,以碳棒为阳极电解100mL饱和食盐水,则阳极的电极反应式为__________________________;当电路中通过0.2mol电子时,阳极可产生的气体____________L(标况下),此时溶液中氢氧化钠的物质的量浓度为________mol.L-1(假设电解前后溶液体积不变).
查看答案和解析>>
科目:高中化学 来源:2011-2012学年浙江省衢州一中高一下学期期中检测化学试卷(带解析) 题型:填空题
(14分)我国是世界上最大的耗煤国家,但每年占总产量70%的煤都被直接烧掉,既浪费了资源又污染环境。因此开发新能源是国家能源发展的方向。
试回答下列问题:
(1)已知1.12LCH4(标况)完全燃烧生成二氧化碳和液态水,可放出44.5KJ的热量,则其热化学方程式为__________;
(2)人们常用“热值”来衡量燃料燃烧放出的热量的大小。“热值”是指常温常压下,1g物质完全燃烧生成稳定物质放出的热量。则CH4的热值是________KJ.g-1
(3)氢气是一种清洁能源,它不仅热值高,而且原料丰富。氢氧燃料电池是以氢气为燃料,氧气是氧化剂,以氢氧化钾为电解质溶液的燃料电池,试写出正、负极的电极反应式:
正极_______________________ ,负极________________________________.
(4)若以上述氢氧燃料电池作电源,以碳棒为阳极电解100mL饱和食盐水,则阳极的电极反应式为__________________________;当电路中通过0.2mol电子时,阳极可产生的气体____________L(标况下),此时溶液中氢氧化钠的物质的量浓度为________mol.L-1(假设电解前后溶液体积不变).
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)煤气化或液化的目的是_______________,_______________。
(2)煤(主要成分为碳)与水蒸汽在高温下可得合成气,1 mol碳完全反应时吸收热量为a kJ(a>0),则其热化学反应方程式为___________________________________。
(3)用合成气在一定条件下合成甲醇的化学方程式(有机物写结构简式)为_________________。
(4)用合成气生产C6H14,其参加反应的CO与H2的体积比为____________________________。
(5)四川各地生长的麻风树中植物油含量极高,用植物油与甲醇在一定条件下进行酯交换可生成生物柴油(脂肪酸甲酯)和甘油。若以油酸甘油酯表示植物油主要成分,写出生产生物柴油的化学方程式(有机物写结构简式):________________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com