
【题目】乙酸橙花酯是一种食用香料,其结构简式如图所示,关于该有机物的下列叙述中错误的是
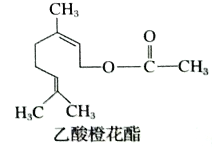
A. 分子式为C12H22O2
B. 能使酸性KMnO4溶液褪色,能发生加成反应和取代反应
C. 1mol该有机物水解时只能消耗1 mol NaOH
D. 1mol该有机物在一定条件下和H2反应,共消耗H2为2mol
 高中必刷题系列答案
高中必刷题系列答案科目:高中化学 来源: 题型:
【题目】一定条件下,将3molA和1molB两种气体混合于固定容积为2L的密闭容器中,发生如下反应:3A(g)+B(g)![]() xC(g)+ 2D(s)。2min末该反应达到平衡,生成0.8molD,并测得C的浓度为0.2mol/L。下列判断正确的是
xC(g)+ 2D(s)。2min末该反应达到平衡,生成0.8molD,并测得C的浓度为0.2mol/L。下列判断正确的是
A. 从开始到平衡A的平均反应速率为0.3mol/(L![]() s)
s)
B. 从开始到平衡B的转化率为60%
C. 此反应的化学平衡常数表达式:![]()
D. 若混合气体的密度或压强不再改变时,该反应一定达到平衡状态
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B 两种元素为同一族第三周期和第四周期元素,若 A 元素的原子序数为 x,则 B 元素的原子序数可能为( )
①x+2 ②x+8 ③x+18 ④x+32
A.③B.②C.②③D.①②
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如右图是研究二氧化硫性质的微型实验装置(实验时用另一表面皿扣在上面)。现用75%硫酸溶液和亚硫酸钠晶体反应制取SO2气体并进行实验,实验现象很明显。下列说法中错误的是

A.品红溶液褪色
B.紫色石蕊溶液先变红后褪色
C.酸性KMnO4溶液紫色褪去
D.含酚酞的NaOH溶液红色变浅
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在容积不变的密闭容器中存在如下反应:2SO2(g)+O2(g) ![]() 2SO3(g) ΔH<0。在其他条件一定,只改变某一条件时,下列分析不正确的是
2SO3(g) ΔH<0。在其他条件一定,只改变某一条件时,下列分析不正确的是

A. 图Ⅰ表示的是t1时刻增大压强对反应速率的影响
B. 图Ⅱ表示的是t1时刻加入催化剂对反应速率的影响
C. 图Ⅲ表示的是温度对平衡的影响,且甲的温度小于乙的温度
D. 图Ⅲ表示的是催化剂对化学平衡的影响,乙使用了催化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温时,下列溶液的pH或微粒的物质的量浓度关系错误的是
A. 某溶液中由水电离出的c(H+)=1×10-amol·L-1,若a>7时,该溶液pH一定为14-a
B. 0.1mol·L-1的KHA溶液,其pH=10,c(K+)>c(HA-)>c(OH-)>c(A2-)
C. 将0.2mol·L-1的某一元酸HA溶液和0.1mol·L-1NaOH溶液等体积混合后溶液pH大于7,则反应后的混合液:c(HA)>c(Na+)>c(A-)
D. 等体积、等物质的量浓度的Na2CO3溶液与 NaHCO3溶液混合:2c(Na+)=3c(CO32-)+3c( HCO3-)+3c(H2CO3)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】第四周期中的18种元素具有重要的用途,在现代工业中备受青睐。
(1)钛原子的价电子排布式为______________________,TiCl4沸点136℃,熔点-25℃,晶体类型为___________晶体。
(2)铜的第二电离能(I2)却大于锌的第二电离能,其主要原因是______________________。
(3)与As同主族的短周期元素是N、P。AsH3中心原子轨道杂化的类型_________________;一定压强下将AsH3、NH3和PH3的混合气体降温时液化顺序是______________________,理由是______________________。
(4)铬是一种硬而脆抗腐蚀性强的金属,常用于电镀和制造特种钢。下图1为铬的晶胞结构图,则铬晶胞属于___________堆积;该晶胞中原子的体积占晶胞体积的百分率为___________。

(5)钴晶体的一种晶胞(如图2所示)的边长为anm,密度为ρg·cm-3,NA表示阿伏加德罗常数的值,则钴原子半径为___________mm,钴的相对原子质量可表示为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】24mL浓度为0.05mol·L-1的Na2SO3溶液,恰好与20mL浓度为0.02mol·L-1的K2Cr2O7,溶液完全反应,则元素Cr在被还原的产物中的化合价是(已知Na2SO3被氧化为Na2SO4)
A.+6B.+3C.+2D.0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NO2、O2和熔融NaNO3可制作燃料电池,其原理如图,下列判断正确的是
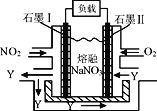
A. 石墨电极Ⅱ为电池负极
B. 电池中NO3-从石墨电极I向石墨电极Ⅱ作定向移动
C. 石墨I电极发生的电极反应为NO2+NO3--e-=N2O5
D. 每消耗1 mol NO2转移电子2 mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com