
【题目】下列有关溶液中粒子浓度关系的叙述正确的是( )
A. 0.1 mol·L1 NH4NO3溶液中:c(![]() )>c(
)>c(![]() )>c(H+)>c(OH)
)>c(H+)>c(OH)
B. 溶有等物质的量NaClO、NaHCO3的溶液中:c(HClO)+c(ClO)=c(CO32)+c(HCO3)+c(H2CO3)
C. 向10 mL 0.2 mol·L1 NaCl溶液中滴入2 mL 0.1 mol·L1 AgNO3溶液,溶液中离子浓度大小关系:c(Na+)>c(![]() )=c(Cl)>c(Ag+)
)=c(Cl)>c(Ag+)
D. 常温下pH=2的醋酸与pH=12的烧碱溶液等体积混合:c(Na+)>c(CH3COO)>c(OH)>c(H+)
【答案】B
【解析】A、NH4+水解,浓度比NO3-小,故A错误;B、溶有等物质的量NaClO、NaHCO3的溶液中,由物料守恒得:c(HClO)+c(ClO)=c(CO32)+c(HCO3)+c(H2CO3)=c(Na+)/2,故B正确;C、硝酸银不足,完全反应,且钠离子、硝酸根离子浓度不变,则离子浓度大小为c(Na+)=c(NO3-)>c(Cl-)>c(Ag+),故C错误;D、pH=2的醋酸,醋酸浓度大于0.01mol·L-1,pH=12的烧碱,NaOH浓度为0.01mol·L-1,等体积混合时醋酸过量,溶液显酸性,则离子浓度为c(CH3COO-)>(Na+)>c(H+)>c(OH-),故D错误;故选B。


科目:高中化学 来源: 题型:
【题目】如图是常见实验仪器或装置。请回答下列问题
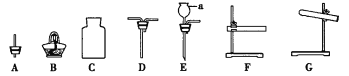
(1)仪器a的名称是__________。
(2)利用高锰酸钾制取并收集O2应选仪器__________(填序号),发生反应的化学方程式为__________。装入药品后,应__________,再塞上橡皮塞,收集氧气时,气体应从D的__________端通入。
(3)用CO还原Fe2O3并检验生成的气体产物,应选仪器__________(填序号);加热前应__________,目的是__________,然后用酒精灯预热,再对准固体加热。处理尾气的方法是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定能在下列溶液中大量共存的离子组为( )
A.含有大量Fe2+的溶液:Na+、NH4+、ClO﹣、SO42﹣
B.含有大量氨水的溶液:Ca2+、Mg2+、Ba2+、NO3﹣
C.含有大量AlO2﹣的溶液:Na+、K+、NO3﹣、CO32﹣
D.含有大量NO3﹣的溶液:H+、I﹣、SO42﹣、Cl﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钴及其化合物在生产中有重要作用,回答下列问题
(1)钴元素基态原子的电子排布式为_________________,未成对电子数为________________。
(2)配合物[Co(NH3)4(H2O)2]Cl3是钴重要化合物
①H2O的沸点___ (填“高于”或“低于”)H2S,原因是_______;H2O中O的杂化形式为_____。H2O是_____分子(填“极性”或“非极性”)。
②[Co(NH3)4(H2O)2]Cl3Co3+配位数为___。阳离子的立体构型是___________。[Co(NH3)4(H2O)2]Cl3若其中有两个NH3分子被Cl取代,所形成的[Co(NH3)2(H2O)2] 3+的几何异构体种数有(不考虑光学异构)___________种。
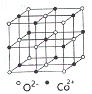
(3)金属钴是由______键形成的晶体;CoO、FeO的晶体结构类型均与氯化钠的相同,Co2+和Fe2+的离子半径分别为74.5pm和78pm,则熔点CoO______FeO。
(4)一氧化钴的晶胞如图,则在每个Co2+的周围与它最接近的且距离相等的Co2+共有_____个,若晶体中Co2+与O2-的最小距离为acm,则CoO的晶体密度为_______(用含NA和a的代数式表示。结果g/cm3,已知:M(Co)=59g/mol;M(O)=16g/mol,设阿佛加德罗常数为NA)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用铂电极电解下表中各组物质的稀溶液(如图)一段时间后,甲、乙两池中溶液的pH均碱小,且在①和④两极的电极产物的物质的量之比为1:2的是( )
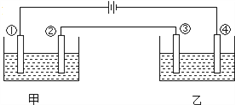
A | B | C | D | |
甲 | KOH | H2SO4 | Na2SO4 | CuSO4 |
乙 | CuSO4 | AgNO3 | HCl | HNO3 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NH4Al(SO4)2是一种食品添加剂,用于焙烤食品;NH4HSO4在分析化学、制药工业中用途广泛。请回答下列问题:
(1)NH4Al(SO4)2可作净水剂,其理由是_______________________ (用必要的化学用语和相关文字说明)。
(2)相同条件下,0.1 mol/L NH4Al(SO4)2溶液中的c(![]() )________(填“等于”、“大于”或“小于”)0.1 mol/L NH4HSO4溶液中的c(
)________(填“等于”、“大于”或“小于”)0.1 mol/L NH4HSO4溶液中的c(![]() )。
)。
(3)如图是0.1 mol/L电解质溶液的pH随温度变化的图像。
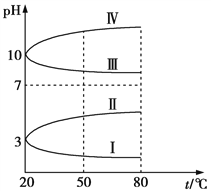
①其中符合0.1 mol/L NH4Al(SO4)2溶液的pH随温度变化的曲线是__________(填写字母),导致pH随温度变化的原因是___________________________________________;
②20℃时,0.1 mol/L的NH4Al(SO4)2溶液中2c(![]() )c(
)c(![]() )3c(Al3+)=_________(填数值)。
)3c(Al3+)=_________(填数值)。
(4)室温时,向100 mL 0.1 mol/L的NH4HSO4溶液中滴加0.1 mol/L NaOH溶液,所得溶液的pH与所加NaOH溶液体积的关系曲线如图所示:
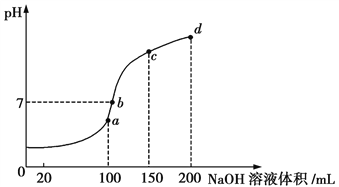
试分析图中a、b、c、d四个点,水的电离程度最大的是____________;在b点,溶液中各离子浓度由大到小的排列顺序是_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业废水中常含有酚类、重金属、氰类、三氯甲烷及砷类等有害物质,必须处理后才可排放。
(1)用FeS除去废水中重金属汞盐的反应为Hg2++FeS![]() HgS + Fe2+,该反应的平衡常数为K=____________ [填数值,已知:Ksp(FeS)=6.4×10-15,Ksp(HgS)=1.6×10-52]。
HgS + Fe2+,该反应的平衡常数为K=____________ [填数值,已知:Ksp(FeS)=6.4×10-15,Ksp(HgS)=1.6×10-52]。
(2)处理含CN-废水有惰性电极电解法、NaClO氧化法等。
已知:HCN的Ka=6.3×10-10,沸点为25.7℃,有剧毒。
①电解前需将废水的pH调至10~11,其目的是___________。
②惰性电极电解时,CN-在阳极最终氧化为CO32-、CO2和N2。则1mol CN-在阳极被完全氧化,同时在阴极上产生H2的物质的量为___________(不考虑副反应)。
③电解后期需在废水中加入食盐继续电解,加食盐除可提高电流效率外,还因为___________。
(3)纳米零价铁除去酸性废水中的三氯乙烯、五价砷的原理如下图所示:
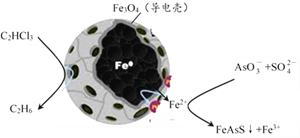
纳米零价铁中Fe为负极, C2HCl3在其表面被还原的电极反应式为___________;在含高浓度SO42-的酸性溶液中脱除砷的化学方程式为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于电解质的导电能力,下列说法正确的是
A.强电解质溶液的导电能力一定比弱电解质溶液的导电能力强
B.导电能力强的溶液一定是浓溶液
C.相同温度下,导电能力强的溶液中离子个数一定多
D.相同的温度下,单位体积中的离子个数越多,阴离子或阳离子所带电荷的绝对值越大,溶液的导电能力越强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用干燥洁净的铂丝蘸取某试样灼烧时,焰色反应为黄色,下列判断正确的是( )
A.该试样一定是钠的化合物B.该试样一定含有钠元素
C.该试样一定是金属钠D.不能确定该试样中是否含有钠元素
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com