
【题目】羟胺的电离方程式为:NH2OH+H2O![]() NH3OH++OH-(25℃时,Kb=9.0×10-9)。用0.lmol/L盐酸滴定20mL 0.lmol/L羟胺溶液,恒定25℃时,滴定过程中由水电离出来的H+浓度的负对数与盐酸体积的关系如图所示(己知:lg3=0.5)。下列说法错误的是( )
NH3OH++OH-(25℃时,Kb=9.0×10-9)。用0.lmol/L盐酸滴定20mL 0.lmol/L羟胺溶液,恒定25℃时,滴定过程中由水电离出来的H+浓度的负对数与盐酸体积的关系如图所示(己知:lg3=0.5)。下列说法错误的是( )
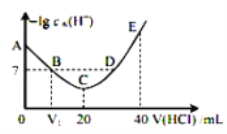
A.图中V1<10
B.A点对应溶液的pH=9.5
C.A、B、C、D四点中酸性最强的点为D点
D.E点对应溶液中存在:c(H+)=c(OH-)+c(NH3OH+)+c(NH2OH)
【答案】D
【解析】
A.羟胺是一元弱碱,若V1=10,则反应恰好起始时产生等量的NH2OH和NH3OH+,NH3OH+的水解常数![]() =1.1×10-5比NH2OH电离常数9.0×10-9大,溶液呈酸性,B点时水的电离达到10-7mol/L,则羟胺过量,需要少滴加一部分HCl,所以V1应<10,故A正确;
=1.1×10-5比NH2OH电离常数9.0×10-9大,溶液呈酸性,B点时水的电离达到10-7mol/L,则羟胺过量,需要少滴加一部分HCl,所以V1应<10,故A正确;
B.羟胺的电离方程式为:NH2OH+H2ONH3OH++OH-,已知25℃时,其电离平衡常数为Kb=9.0×l0-9,起始浓度为c0=0.1mol/L,溶液中c(OH-)=![]() =
=![]() =3.0×10-5mol/L,c(OH-)=
=3.0×10-5mol/L,c(OH-)=![]() mol/L=
mol/L=![]() ×10-9mol/L,pH=-lg
×10-9mol/L,pH=-lg![]() ×10-9mol=9+lg3=9.5,故B正确;
×10-9mol=9+lg3=9.5,故B正确;
C.C点溶液中水电离生成的氢离子最大,则C点盐酸与羟胺恰好完全反应产生NH3OHCl,C点以后HCl过量,所以D点酸性最强,溶液呈酸性,故C正确;
D.E点时加入HCl的体积为40mL,根据电荷守恒:c(H+)+c(NH3OH+)=c(OH-)+c(Cl-),根据物料守恒:2c(NH3OH+)+2c(NH2OH)=c(Cl-),则有c(H+)=c(OH-)+c(NH3OH+)+2c(NH2OH),故D错误;
故答案为D。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】已知:Zn(s)+1/2O2(g)=ZnO(s) △H=-350.5kJ·mol-1
Hg(l)+1/2O2(g)=HgO(s) △H=-90.8kJ·mol-1
则反应Zn(s)+HgO(s)=ZnO(s)+Hg(l)的△H为( )
A. +519.4kJ·mol-1B. +259.7 kJ·mol-1
C. -259.7 kJ·mol-1D. -519.4kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钢铁很容易生锈而被腐蚀,每年因腐蚀而损失的钢材占世界钢铁年产量的1/10。
(1)钢铁腐蚀主要是吸氧腐蚀,该腐蚀过程中的电极反应式。
正极:____________;负极:________。
(2)为了降低某水库的铁闸门被腐蚀的速率,可以采用下图所示甲的方案,其中焊接在铁闸门的固体材料R可以采用___。
A、铜 B、钠 C、锌 D、石墨
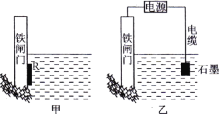
(3)上图中乙方案也可降低铁闸门腐蚀速率,其中铁闸门应该连接在直流电源的________极。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向某密闭容器中充入NO2,发生反应2NO2(g)![]() N2O4(g)。其它条件相同时,不同温度下平衡体系中各物质的物质的量分数如下表:(已知:N2O4为无色气体)
N2O4(g)。其它条件相同时,不同温度下平衡体系中各物质的物质的量分数如下表:(已知:N2O4为无色气体)
t/℃ | 27 | 35 | 49 | 70 |
NO2% | 20 | 25 | 40 | 66 |
N2O4% | 80 | 75 | 60 | 34 |
下列说法不正确的是( )
A.27℃,该平衡体系中的NO2转化率为![]()
B.平衡时,NO2的消耗速率为N2O4消耗速率的2 倍
C.室温时,将盛有NO2的密闭玻璃球放入冰水中其颜色会变浅
D.其他条件不变,增大NO2起始量,平衡正移,该反应的化学平衡常数增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硅酸(H2SiO3)是一种难溶于水的弱酸,从溶液中析出时常形成凝胶状沉淀。实验室常用Na2SiO3溶液制备硅酸。某小组同学进行了如下实验:下列结论不正确的是( )
编号 | Ⅰ | Ⅱ |
实验 |
|
|
现象 | a 中产生凝胶状沉淀 | b 中凝胶状沉淀溶解,c 中无明显变化 |
A.Na2SiO3溶液一定显碱性
B.由Ⅰ能说明酸性H2CO3>H2SiO3
C.由Ⅱ可知,同浓度时Na2CO3溶液的碱性强于NaHCO3溶液
D.向Na2SiO3溶液中通入少量CO2,发生反应:SiO32-+CO2+H2O=CO32-+H2SiO3↓
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设氯原子的质量为ag,12C原子的质量为bg,用NA表示阿伏加德罗常数的值,则下列说法不正确的是( )
A.该氯原子的相对原子质量为![]() B.mg该氯原子的物质的量为
B.mg该氯原子的物质的量为![]() mol
mol
C.该氯原子的摩尔质量是aNAgD.ng该氯原子所含的电子数是![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组利用H2C2O4溶液和酸性KMnO4溶液反应来探究“条件对化学反应速率的影响”。实验时,先分别量取两种溶液,然后倒入试管中迅速振荡,混合均匀,开始计时,通过测定褪色所需时间来判断反应的快慢。该小组设计了如下方案:
编号 | H2C2O4溶液 | 酸性KMnO4溶液 | 温度/℃ | ||
浓度(mol/L) | 体积/mL | 浓度(mol/L) | 体积/mL | ||
① | 0.10 | 2.0 | 0.01 | 4.0 | 25 |
② | 0.20 | 2.0 | 0.01 | 4.0 | 25 |
③ | 0.20 | 2.0 | 0.01 | 4.0 | 50 |
(1)已知反应后H2C2O4转化为CO2逸出,为了观察到紫色褪去,H2C2O4与KMnO4初始的物质的量需要满足的关系为:n(H2C2O4)∶n(KMnO4) ______________。
(2)探究温度对化学反应速率影响的实验编号是_______ (填编号,下同),可探究反应物浓度对化学反应速率影响的实验编号是 ________.
(3)实验①测得KMnO4溶液的褪色时间为40s,忽略混合前后溶液体积的微小变化,这段时间内平均反应速率v(KMnO4)=_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA为阿伏加德罗常数,下列描述正确的是
A.含有NA个氦原子的氦气在标准状况下的体积约为11.2L
B.40gNaOH溶解在1L水中,所制得的溶液,物质的量浓度为1molL﹣1
C.标准状况下,11.2L四氯化碳所含分子数为0.5NA
D.常温常压下,5.6g铁与过量的盐酸反应转移电子总数为0.2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(NH4)2Cr2O7可用作有机合成催化剂、媒染剂 、显影液等。 某化学兴趣小组对(NH4)2Cr2O7 的部分性质及组成进行探究 。已知 :Cr2O72-(橙色)+H2O22 CrO42- (黄色)+2H+。 请回答下列问题
(1)向盛有少量(NH4)2Cr2O7 固体的试管中.滴加足量浓KOH溶液.振荡、微热 ,观察到的实验现象有_______________ 。
(2) 为探究(NH4)2Cr2O7 (摩尔质量为 252g/mol)的分解产物 .按下图连接好装置,在A中加入5.040 g 样品进行实验 。
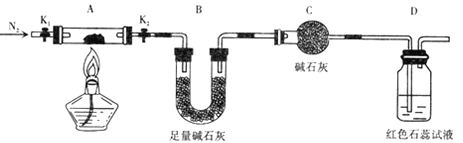
①仪器C的名称是____________ 。
②连接好装置后需进行的必要橾作是 ________,点燃酒精灯之前需进行的必要橾作是
___________________________。
③反应结束后.依然要通一段时间氮气的原因是 ____________________ .
④加热A至恒重,观察到D中溶液不变色,同时测得A中残留物为 Cr2O3 ,B中质量变化为1.44g. 写出( NH4)2Cr2O7加热分解的化学方程式:____________。
(3)实验室常用甲醛法测定含( NH4)2Cr2O7 的样品中氮的质量分数(杂质不发生反应),其反应原理为2Ba2++ Cr2O72-+H2O=2BaCrO4↓+2H+、4NH4++6HCHO=3H++6H2O +(CH2)6N4H+[ 滴定时 l mol(CH2)6N4H+ 与 l mol H+ 相当].然后用 NaOH标准溶液滴定 反应生成的酸。
实验步骤:称取品8.400g. 配成500mL溶液,移取25.00mL, 样品溶液于250mL锥形瓶中.用氯化钡溶液使Cr2O72- 完全沉淀后加入15.00mL2 0.00molL-1的中性甲醛溶液,摇 匀、静置5min 后,加入1- 2 滴酚酞试液 ,用0 .2000molL-1 NaOH标准溶液滴定至终点。重复上述操作 3次,最终滴定用去NaOH 标准溶液体积的平均值为 30.00mL。
①若滴定终点时,仰视读数。则测定结果 ____(填 “偏大”“偏小”或“无影响 ”)。
②样品中氮的质量分数为 _____________ 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com