
| 离子 | Na+ | Mg2+ | Cl- | SO${\;}_{4}^{2-}$ |
| 浓度/(g.l-2) | 63.7 | 28.8 | 144.6 | 46.4 |
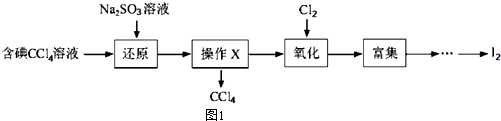
分析 (1)碘具有强氧化性,能将亚硫酸根离子氧化为硫酸根离子,自身被还原生成碘离子;将碘还原为碘离子,目的是利用分液法除去四氯化碳;
(2)分离互不相溶的液体采用分液方法;使用的仪器是分液漏斗;
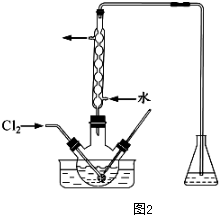
(3)碘不稳定,易升华,且温度高时气体难溶解;碘能和强碱溶液反应;
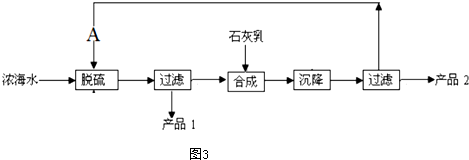
(4)工艺流程合成步骤中加入石灰乳,沉降后,将过滤后的滤液进行脱硫,应是用钙离子沉淀硫酸根离子生成硫酸钙沉淀,产品1为硫酸钙,合成得到氢氧化镁沉淀,故过滤后干燥的产品2为氢氧化镁,计算1L溶液中Mg2+的质量,根据Mg2+~Mg(OH)2计算氢氧化镁的质量.
解答 解:(1)碘具有强氧化性,能将亚硫酸根离子氧化为硫酸根离子,自身被还原生成碘离子,离子方程式为SO32-+I2+H2O=2I-+SO42-+2H+;将碘还原为碘离子,目的是利用分液法除去四氯化碳,所以该操作将I2还原为I-的目的是使四氯化碳中的碘单质转化为碘离子进入溶液,
故答案为:SO32-+I2+H2O=2I-+SO42-+2H+;将I2还原为I-的目的是使四氯化碳中的碘单质转化为碘离子进入溶液;
(2)分离互不相溶的液体采用分液方法,分离四氯化碳和水溶液采用分液方法,所以X操作为分液;使用的仪器是分液漏斗,
故答案为:分液;分液漏斗;
(3)碘不稳定,易升华,且温度高时气体难溶解,所以温度较低的原因是:防止碘升华或者被氧化、增大氯气溶解度;碘能和强碱溶液反应,锥形瓶中液体是NaOH溶液,
故答案为:防止碘升华或者被氧化、增大氯气溶解度;NaOH溶液;
(4)工艺流程合成步骤中加入石灰乳,沉降后,将过滤后的滤液进行脱硫,用Ca2+沉淀SO42-生成CaSO4沉淀,离子方程式为:Ca2++SO42-=CaSO4↓,采用过滤的方法得到产品1为CaSO4,滤液中加入石灰乳,发生反应为Mg2++2OH-=Mg(OH)2↓,合成中应得到Mg(OH)2沉淀,过滤、干燥的产品2为Mg(OH)2,
溶液中m(Mg2+)=1L×28.8g/L=28.8g,
Mg2+~Mg(OH)2
24g 58g
28.8g m[Mg(OH)2]
m[Mg(OH)2]=28.8g×$\frac{58g}{24g}$=69.6g,
故答案为:Ca2++SO42-=CaSO4↓;Mg(OH)2;69.6.
点评 本题考查海水资源综合利用,涉及物质的提纯和分离、氧化还原反应、计算等知识点,知道流程图中发生的反应及基本操作,会根据物质的性质设计实验,难点是④,注意化学语言的准确性,题目难度中等.


科目:高中化学 来源: 题型:解答题
 在用如图所示实验装置(夹持仪器已略去)探究铜丝与过量浓硫酸的反应.
在用如图所示实验装置(夹持仪器已略去)探究铜丝与过量浓硫酸的反应.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
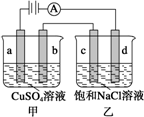
| A. | 向乙中加入适量盐酸,溶液组成可以恢复 | |
| B. | 电解时向乙中滴入酚酞溶液,c电极附近变红 | |
| C. | 当b极有64gCu析出时,c电极产生2g气体 | |
| D. | 甲中a极上的电极反应式为:4OH--4e-=O2↑+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CO过量 | B. | CO与铁矿石接触不充分 | ||
| C. | 炼铁高炉的高度不够 | D. | CO与Fe2O3的反应有一定限度 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(Na+)+c(H+)=c(OH-)+c(HS-)+c(S2-) | B. | c(Na+)=2c(HS-)+2c(S2-)+c(H2S) | ||
| C. | c(Na+)>c(OH-)>c(HS-)>c(H+) | D. | c(H2S)+c(HS-)+c(H+)=c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 淀粉、纤维素最终水解产物均为单糖 | |
| B. | 蛋白质最终水解产物是多肽 | |
| C. | 蔗糖、麦芽糖水解产物相同 | |
| D. | 酯在强碱作用下水解生成对应的酸和醇 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用惰性电极电解MgCl2溶液:2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$ Cl2↑+H2↑+2OH- | |
| B. | 向石灰水中滴加少量Ca(HCO3)2溶液:Ca2++2HCO3-+2OH-=CaCO3↓+CO32-+2H2O | |
| C. | 过氧化钠与水反应:2O22-+2H2O=4OH-+O2↑ | |
| D. | 一定量明矾溶液中滴加Ba(OH)2溶液至沉淀的质量最大时:2Ba2++4OH-+Al3++2SO42-=2BaSO4↓+AlO2-+2H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com