
分析 (1)由实验一和实验二中的现象分析;
(2)NO、NO2等体积通入浓硫酸中反应生成NOHSO4,根据原子守恒书写方程式;
(3)NO2能溶于浓硫酸,NO2与无水氯化钙不反应;Pb(NO3)2加热分解生成NO2和PbO、O2.
解答 解:(1)实验一:将制得的纯净的NO2通入浓硫酸中,溶液变成棕黄色,加热浓硫酸,气体逸出,溶液颜色褪去,说明NO2溶于浓硫酸但不与浓硫酸反应;
实验二:将制得的纯净的NO通过浓硫酸后用排水集气法收集到足量无色气体,通入氧气后气体变成红棕色,说明NO不溶于浓硫酸也不与浓硫酸反应;
故答案为:NO2溶于浓硫酸但不与浓硫酸反应,NO不溶于浓硫酸也不与浓硫酸反应;
(2)NO、NO2等体积通入浓硫酸中反应生成NOHSO4,由原子守恒书写出方程式为NO+NO2+2H2SO4=2NOHSO4+H2O;
故答案为:NO+NO2+2H2SO4=2NOHSO4+H2O;
(3)能溶于浓硫酸,所以不能用浓硫酸干燥NO2,NO2与无水氯化钙不反应,所以可以用无水氯化钙干燥NO2;Pb(NO3)2加热分解生成NO2和PbO、O2,反应方程式为:2Pb(NO3)2$\frac{\underline{\;\;△\;\;}}{\;}$2PbO+4NO2↑+O2↑;
故答案为:无水氯化钙;2Pb(NO3)2$\frac{\underline{\;\;△\;\;}}{\;}$2PbO+4NO2↑+O2↑.
点评 本题考查了氮的氧化物的性质、干燥剂的选择、化学方程式等,题目难度中等,侧重于考查学生的分析能力和对题中信息的应用能力.


 中考解读考点精练系列答案
中考解读考点精练系列答案科目:高中化学 来源: 题型:选择题
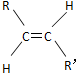 和
和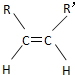 两种空间形式(同分异构体),判断下列化合物中具有上述两种空间排列形式的是( )
两种空间形式(同分异构体),判断下列化合物中具有上述两种空间排列形式的是( )| A. | 乙烯 | B. | 2-戊烯 | C. | 苯乙烯 | D. | 乙烷 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 研制乙醇汽油代替汽油作汽车燃料 | |
| B. | 利用乙烯和氯化氢在催化剂存在的条件下生成氯乙烷 | |
| C. | 在萃取操作的演示实验中,将CCl4萃取溴水改为CCl4萃取碘水 | |
| D. | 用铜和浓H2SO4反应制取Cu SO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 元素X形成的单质一定是原子晶体 | |
| B. | X与Z形成的化合物具有熔点高、硬度大的特点 | |
| C. | Y与氧元素形成的化合物Y2O2中阴、阳离子的个数比为1:1 | |
| D. | W分别与Y、Z形成的化合物中含有的化学键类型相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 稀H2SO4和稀Ba(OH)2溶液反应的热化学方程式为:$\frac{1}{2}$H2SO4(aq)+$\frac{1}{2}$Ba(OH)2(aq)=$\frac{1}{2}$BaSO4(s)+H2O(l)△H=-57.3kJ/mol | |
| B. | 1molCO(g)完全燃烧时放热283.0kJ,则2CO2(g)=2CO(g)+O2(g)反应的△H=+566kJ/mol | |
| C. | 需要加热才能发生的反应一定是吸热反应 | |
| D. | NaOH溶液与稀H2SO4反应中和热的化学方程式为2NaOH(aq)+H2SO4(aq)=Na2SO4(aq)+2H2O(l)△H=-114.6kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 醋酸亚铬水合物{[Cr(CH3COO2)]2•2H2O,深红色晶体}易被氧气氧化,是一种氧气吸收剂,通常以二聚体分子的形式存在,不溶于水,易溶于盐酸.实验室制备醋酸亚铬水合物的装置如图所示.
醋酸亚铬水合物{[Cr(CH3COO2)]2•2H2O,深红色晶体}易被氧气氧化,是一种氧气吸收剂,通常以二聚体分子的形式存在,不溶于水,易溶于盐酸.实验室制备醋酸亚铬水合物的装置如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:推断题
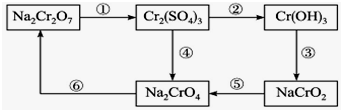 铬是水体的主要的污染物之一,可以导致水生生物死亡.化学实验中,如使某步中的有害产物作为另一步的反应物,形成一个循环,就可不再向环境排放该有害物质.例如处理铬的实验循环示意图如图:
铬是水体的主要的污染物之一,可以导致水生生物死亡.化学实验中,如使某步中的有害产物作为另一步的反应物,形成一个循环,就可不再向环境排放该有害物质.例如处理铬的实验循环示意图如图:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2SO4的摩尔质量是98 | |
| B. | 等物质的量的O2和O3中所含的氧原子数相同 | |
| C. | 等质量的CO与CO2中所含碳原子数之比为11:7 | |
| D. | 将98g H2SO4溶解于500mL水中,所得溶液中硫酸的物质的量浓度为2 mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cl-离子的结构示意图: | |
| B. | 水分子的电子式: | |
| C. | 乙醇的结构简式:C2H6O | |
| D. | 硫酸钠的电离方程式:Na2SO4=2Na++SO42- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com