
| 族 周期 | IA | 0 | ||||||
| 1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
| 2 | ② | ③ | ④ | |||||
| 3 | ⑤ | ⑥ | ⑦ | ⑧ | ||||
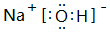 .
.分析 由元素在周期表中的位置可知:①为H,②为C,③为N,④为O,⑤为Na,⑥为Al,⑦为Si,⑧为Cl.
(1)同周期自左而右原子半径减小,同主族自上而下原子半径增大;
(2)非金属性越强,最高价含氧酸的酸性越强;
(3)①、④、⑤、⑧中的某些元素可形成既含离子键又含共价键的化合物有NaOH、NaClO等;
(4)表中两种元素的原子按1:1组成的常见液态化合物为H2O2,在MnO2或FeCl3催化作用下分解,而Na2SO3具有还原性,与H2O2发生氧化还原反应,高锰酸钾具有强氧化性,与H2O2发生氧化还原反应;
(5)由①和②两种元素组成的某种物质是天然气的主要成分,该物质为CH4,计算1mol甲烷燃烧放出的热量,注明物质的聚集状态与反应热书写热化学方程式;
(6)碳与Al单质用导线连接,放入氢氧化钠溶液中,构成原电池,Al发生氧化反应,Al为负极,碱性条件下生成偏铝酸根与水.
解答 解:由元素在周期表中的位置可知:①为H,②为C,③为N,④为O,⑤为Na,⑥为Al,⑦为Si,⑧为Cl.
(1)同周期自左而右原子半径减小,同主族自上而下原子半径增大,故原子半径:Na>Al>O,故答案为:Na>Al>O;
(2)非金属性:Cl>C>Si,元素的非金属性越强,对应的最高价含氧酸的酸性越强,则HClO4>H2CO3>H2SiO3 ,故答案为:HClO4>H2CO3>H2SiO3 ;
(3)①、④、⑤、⑧中的某些元素可形成既含离子键又含共价键的化合物有NaOH、NaClO等,NaOH的电子式为: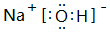 ,
,
故答案为: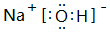 ;
;
(4)两种元素的原子按1:1组成的常见液态化合物为H2O2,在MnO2或FeCl3催化作用下分解,而Na2SO3具有还原性,与H2O2发生氧化还原反应,不能用作催化剂,高锰酸钾具有强氧化性,与H2O2发生氧化还原反应,也不能作催化剂,
故答案为:ab;
(5)由①和②两种元素组成的某种物质是天然气的主要成分,该物质为CH4,1mol甲烷燃烧放出的热量为222.5kJ×$\frac{1mol×16g/mol}{4g}$=890kJ,反应热书写热化学方程式为:CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H=-890kJ/mol,
故答案为:CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H=-890kJ/mol;
(6)碳与Al单质用导线连接,放入氢氧化钠溶液中,构成原电池,该装置可实现由化学能转化为电能,Al发生氧化反应,Al为负极,碱性条件下生成偏铝酸根与水,电极反应式为:Al-3e-+4 OH-=AlO2-+2H2O,
故答案为:化学;电能;负;Al-3e-+4 OH-=AlO2-+2H2O.
点评 本题考查了元素周期表与元素周期律、电子式、热化学方程式、原电池等,熟练掌握前四周期元素在周期表位置,理解原电池工作原理.


科目:高中化学 来源: 题型:解答题
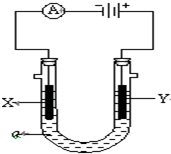 电解原理在化学工业中有广泛应用.图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题:
电解原理在化学工业中有广泛应用.图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 目前我国流通的硬币是由合金材料制造的 | |
| B. | 锡青铜的熔点比纯铜高 | |
| C. | 镁在空气中燃烧发出耀眼的白光,可用于制作照明弹 | |
| D. | 日用铝制品表面覆盖着氧化膜,对内部金属起保护作用 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
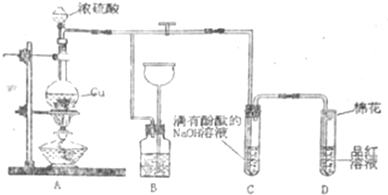
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
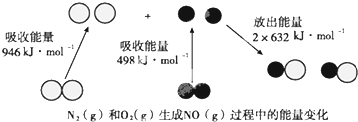
| A. | N≡N键的键能为946kJ•mol-1 | |
| B. | N2(g)+O2(g)═2NO(g)△H=+180kJ•mol-1 | |
| C. | 当有16gO2(g)参加反应时,该反应吸收90kJ热量 | |
| D. | 当有1mol电子发生转移时,该反应吸收90kJ热量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
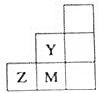
| A. | 非金属性:Y>Z>M | |
| B. | 离子半径:M->Z2->Y- | |
| C. | Z元素存在同素异形现象 | |
| D. | 三种元素中,Y的最高价氧化物对应的水化物酸性最强 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
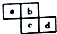
| A. | 原子半径:c>d>a>b | |
| B. | 原子序数d可能是a的3倍 | |
| C. | 最高价含氧酸的酸性c可能比d强 | |
| D. | 四种元素的氢化物可能是18电子分子 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com