
| A.电池工作时,锌失去电子 |
| B.电池正极反应式为: 2MnO2+H2O+2e-= Mn2O3+2OH- |
| C.电池工作时,负极附近pH降低 |
| D.正极是水电离出的H+得到电子 |
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:不详 题型:单选题

| A.图1、图2中电解质溶液的pH均增大 |
| B.图2中电解AlCl3溶液的总反应为2Cl-+2H2OCl2↑+H2↑+2OH- |
| C.A处通入的气体为CH4,电极反应式为CH4+10OH--8e-===CO+7H2O |
| D.燃料电池内部OH-向a极移动,电解池中Cl-向x极移动 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 H2+I2
H2+I2查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.①② | B.②③ | C.只有② | D.只有③ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.1mol | B.2mol | C.4mol | D.6mol |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

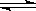 2NO为例)、人工固氮(以N2+3H2
2NO为例)、人工固氮(以N2+3H2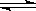 2NH3为例)反应的平衡常数
2NH3为例)反应的平衡常数 的值如下表。
的值如下表。| 反应 | N2+02 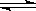 2NO 2NO | N2+3H2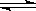 2NH3 2NH3 | ||
| 温度/℃ | 27 | 2000 | 100 | 400 |
| K | 3.84×10-31 | 0.1 | 3.4×109 | 2.0x104 |
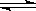 2NH3(g)
2NH3(g) 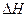 =-92.4kJ·mol-1
=-92.4kJ·mol-1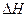 ="-571.6" kJ·mol-1
="-571.6" kJ·mol-1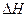 = KJ·mol-1。
= KJ·mol-1。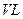 的密闭容器中进行反应:N2(g)+3H2(g)
的密闭容器中进行反应:N2(g)+3H2(g) 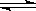 2NH3(g),其
2NH3(g),其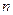 (H2)和
(H2)和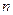 (NH3)随时间变化的关系如图所示。
(NH3)随时间变化的关系如图所示。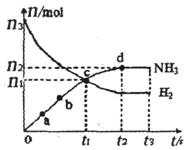
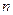 (H2)将增大
(H2)将增大 (H2)= 。
(H2)= 。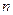 (N2)=
(N2)=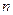 (H2),则反应的平衡常数
(H2),则反应的平衡常数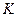 = (用代数式表示)。
= (用代数式表示)。查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.通乙烷的电极为负极,电极反应为:C2H6+18OH――14e—=2CO32-+12H2O |
B.参加 反应的O2与C2H6的物质的量之比为7∶2 反应的O2与C2H6的物质的量之比为7∶2 |
| C.放电一段时间后,KOH的物质的量浓度将下降 |
D.放电一段时间后,正极 区附近溶液的pH减小 区附近溶液的pH减小 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

 CH4可用于设计燃料电池。甲烷燃料电池的工作原理如下图所示:
CH4可用于设计燃料电池。甲烷燃料电池的工作原理如下图所示:
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 。
。查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com