
| A. | H2+I2(g)?2HI△H>0 | B. | N2+3H2?2NH3△H<0 | ||
| C. | 2SO3(g)?2SO2+O2△H>0 | D. | 4NH3+5O2(g)?4NO+6H2O(g)△H<0 |
分析 A.反应前后气体体积不变,正反应是吸热反应,升温平衡正向进行,气体质量和物质的量不变;
B.反应前后气体体积减小的放热反应,升温平衡逆向进行,气体物质的量增大,气体质量不变;
C.反应前后气体物质的量增大的吸热反应,升温平衡正向进行,气体质量不变,气体物质的量增大;
D.反应前后气体物质的量增大的放热反应,升温平衡逆向进行,气体质量不变物质的量减小;
解答 解:$\overline{M}$=$\frac{m}{n}$据此计算式中气体总质量和总物质的量变化分析选项,
A.H2+I2(g)?2HI△H>0,反应前后气体体积不变,正反应是吸热反应,升温平衡正向进行,气体质量和物质的量不变,升高温度,可使混合气的平均摩尔质量不变,故A错误;
B.N2+3H2?2NH3△H<0,反应前后气体体积减小的放热反应,升温平衡逆向进行,气体物质的量增大,气体质量不变,升高温度,可使混合气的平均摩尔质量减小,故B错误;
C.2SO3(g)?2SO2+O2△H>0,反应前后气体物质的量增大的吸热反应,升温平衡正向进行,气体质量不变,气体物质的量增大,升高温度,可使混合气的平均摩尔质量减小,故C错误;
D.4NH3+5O2(g)?4NO+6H2O(g)△H<0,反应前后气体物质的量增大的放热反应,升温平衡逆向进行,气体质量不变物质的量减小,升高温度,可使混合气的平均摩尔质量增大,故D正确;
故选D.
点评 本题考查了化学平衡影响因素分析,平衡移动原理的理解应用和反应的特征是解题关键,题目难度中等.


 小学教材全测系列答案
小学教材全测系列答案 小学数学口算题卡脱口而出系列答案
小学数学口算题卡脱口而出系列答案 优秀生应用题卡口算天天练系列答案
优秀生应用题卡口算天天练系列答案 浙江之星课时优化作业系列答案
浙江之星课时优化作业系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1mol/LNa2S2O3 和 H2SO4 各 5mL,加水 5mL,反应温度 10℃ | |
| B. | 0.1mol/LNa2S2O3 和 H2SO4 各 5mL,加水 10mL,反应温度 10℃ | |
| C. | 0.1mol/LNa2S2O3 和 H2SO4 各 5mL,加水 5mL,反应温度 30℃ | |
| D. | 0.1mol/LNa2S2O3 和 H2SO4 各 5mL,加水 10mL,反应温度 30℃ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
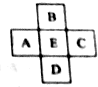 原子序数为x的元素E在周期表中位于A、B、C、D四种元素中间(如图所示),则A、B、C、D四种元素的原子序数之和不可能是(镧系、锕系、O族元素除外)( )
原子序数为x的元素E在周期表中位于A、B、C、D四种元素中间(如图所示),则A、B、C、D四种元素的原子序数之和不可能是(镧系、锕系、O族元素除外)( )| A. | 4x | B. | 4x+6 | C. | 4x+10 | D. | 4x+14 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 A、B、C、D、E、F为元素周期表前四周期的元素,原子序数依次增大,A元素的单质是空气的主要成分,B原子核外p轨道上有1对成对电子,C与B同主族,D元素的价电子数是其余电子数的一半,E与D同族,F与A同主族,回答下列问题:
A、B、C、D、E、F为元素周期表前四周期的元素,原子序数依次增大,A元素的单质是空气的主要成分,B原子核外p轨道上有1对成对电子,C与B同主族,D元素的价电子数是其余电子数的一半,E与D同族,F与A同主族,回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | AgCl的溶解度增大 | B. | AgCl的溶解度增大,Ksp不变 | ||
| C. | C(Ag+)增大 | D. | AgCl的溶解度、Ksp均不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某同学通过查阅资料得知,铝热反应所得到的熔融物应该是铁铝合金.
某同学通过查阅资料得知,铝热反应所得到的熔融物应该是铁铝合金.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com