

 ,G→I一步反应的产物除了I、N(C2H5)3、还有NaCl
,G→I一步反应的产物除了I、N(C2H5)3、还有NaCl .
. 或
或 .
. 分析 化合物A能使溴的四氯化碳溶液褪色,结合C的结构简式以及A、B分子式可知,A为(CH3)2C=CH2,B为Cl3C-CHO;F为 ,和氢氧化钠水溶液反应,故G为
,和氢氧化钠水溶液反应,故G为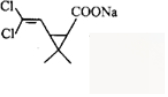 ,以此解答(1)~(5);
,以此解答(1)~(5);
(6)J比F的分子只少一个氧多两个氢原子,则J的分子式为C10H16OCl2,分子中含有4个不饱和度,则分子中除含有一个苯环外,其余碳原子均为饱和碳原子.根据题意,J分子中含有3种氢原子,且个数比为9:2:1,其中有9个氢原子为一种,则可能含有3个相同的甲基或-C(CH3)3,不与FeCl3溶液显色,故分子中没有酚羟基;
(7)C为CH2=C(CH3)CH2CHOHCCl3,在碱性条件下水解,碳原子上连有两个或三个羟基时,容易发生分子内脱水,两个羟基脱一分子水形成一个碳氧双键,可K为CH2=C(CH3)CH2CHOHCOONa,L为CH2=C(CH3)CH2CHOHCOOH,L可发生缩聚或加聚反应.
解答 解:(1)F的分子式为C10H14O2Cl2,根据I的结构简式,可知其含有的官能团有:氯原子、碳碳双键、酯基、醚键,
故答案为:C10H14O2Cl2;氯原子、碳碳双键、酯基、醚键;
(2)F→G反应为 +NaOH$\stackrel{{H}_{2}O}{→}$
+NaOH$\stackrel{{H}_{2}O}{→}$ +C2H5OH,故为取代反应,
+C2H5OH,故为取代反应,
故答案为:取代反应;
(3)由以上分析得A为(CH3)2C=CH2,B为Cl3C-CHO,
故答案为:(CH3)2C=CH2;Cl3C-CHO;
(4)D的结构简式为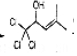 ,与碳碳双键直接相连的原子在同一个平面上,D分子中最多有10个原子共平面,
,与碳碳双键直接相连的原子在同一个平面上,D分子中最多有10个原子共平面,
故答案为:10;
(5)对比G、I的结构可知,G中Na被取代生成I,同时生成N(CH2CH3)3,根据化学反应前后元素守恒,故另一生成物NaCl,
故答案为:NaCl;
(6)J比F的分子只少一个氧多两个氢原子,则J的分子式为C10H16OCl2,分子中含有4个不饱和度,则分子中除含有一个苯环外,其余碳原子均为饱和碳原子.根据题意,J分子中含有3种氢原子,且个数比为9:2:1,其中有9个氢原子为一种,则可能含有3个相同的甲基或-C(CH3)3,不与FeCl3溶液显色,故分子中没有酚羟基,故J可能的结构为 ,
,
故答案为: ;
;
(7)C为CH2=C(CH3)CH2CHOHCCl3,在碱性条件下水解,碳原子上连有两个或三个羟基时,容易发生分子内脱水,两个羟基脱一分子水形成一个碳氧双键,可K为CH2=C(CH3)CH2CHOHCOONa,L为CH2=C(CH3)CH2CHOHCOOH,
①C为CH2=C(CH3)CH2CHOHCCl3,K为CH2=C(CH3)CH2CHOHCOONa,C→K的反应方程式为CH2=C(CH3)CH2CHOHCCl3+4NaOH$\stackrel{△}{→}$CH2=C(CH3)CH2CHOHCOONa+3NaCl+2H2O,
故答案为:CH2=C(CH3)CH2CHOHCCl3+4NaOH$\stackrel{△}{→}$CH2=C(CH3)CH2CHOHCOONa+3NaCl+2H2O;
②L为CH2=C(CH3)CH2CHOHCOOH,可发生缩聚或加聚反应,产物可为 或
或 ,
,
故答案为: 或
或 .
.
点评 本题考查有机物推断与合成,为高频考点,题目涉及官能团结构与性质、同分异构体书写、有机反应方程式书写等,是对有机化学的综合可知,侧重考查学生分析推理、知识迁移应用,难点中等.


 考前必练系列答案
考前必练系列答案科目:高中化学 来源: 题型:选择题
| A. | H${\;}_{2}^{16}$O、D${\;}_{2}^{16}$O、H${\;}_{2}^{18}$O、D${\;}_{2}^{18}$O互为同位素 | |
| B. | 金刚石、石墨均为碳的同素异形体,其化学性质与物理性质均相似 | |
| C. | 石墨烯(结构如图 所示)是由碳原子构成的单层片状结构的新材料,与石墨互为同位素 所示)是由碳原子构成的单层片状结构的新材料,与石墨互为同位素 | |
| D. | 由于氢原子可以形成H-(如NaH),所以有人建议可将氢元素排在元素周期表的ⅦA族 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
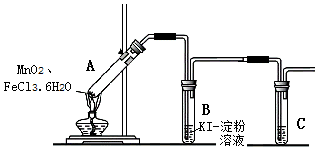
| 操作 | 现象 |
| (1)经检查,装置气密性良好. (2)添加药品,连接装置. (3)点燃酒精灯. | i.A中部分固体熔化,上方出现白雾; ii.稍后,产生黄色气体,管壁附着黄色液滴; iii.B中溶液变蓝. |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
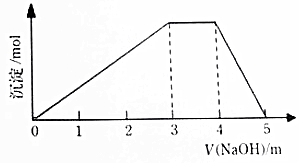 中学常见的短周期主族元素R、X、Y、Z、M的原子序数依次增大,它们占据三个周期.Y和M位于同主族,Y原子最外层电子数是电子层数的3倍.这五中元素组成一种离子化合物Q.取一定量Q溶于蒸馏水得到溶液,向溶液中滴加稀氢氧化钠溶液,产生沉淀与氢氧化钠溶液体积如图所示,下列说法不正确的是( )
中学常见的短周期主族元素R、X、Y、Z、M的原子序数依次增大,它们占据三个周期.Y和M位于同主族,Y原子最外层电子数是电子层数的3倍.这五中元素组成一种离子化合物Q.取一定量Q溶于蒸馏水得到溶液,向溶液中滴加稀氢氧化钠溶液,产生沉淀与氢氧化钠溶液体积如图所示,下列说法不正确的是( )| A. | 简单的离子半径:M>Y>Z | |
| B. | 气态氢化物的热稳定性:Y>X | |
| C. | 由R、X、Y、M四种元素只组成一种盐 | |
| D. | 最高价氧化物对应水化物的酸性:M>Z |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
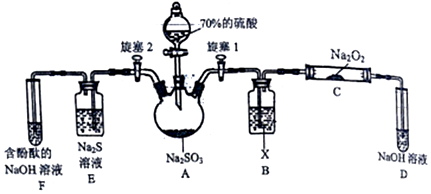
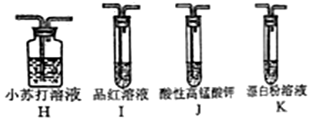
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 当0<b<$\frac{a}{3}$时:SO2+H2O+3ClO-=SO42-+2HClO+Cl- | |
| B. | 当b=a时,SO2+H2O+ClO-═2H++Cl-+SO42- | |
| C. | 当$\frac{a}{3}$≤b≤a时,反应后溶液中H+的物质的量:0<n(H+)≤2bmol | |
| D. | 当0<b<a时,反应后溶液中ClO-、Cl-和SO42-物质的量之比为:(a-b):b:b |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 化学式 | 电离常数 |
| HClO | K=3×10-9 |
| H2CO3 | K1=4.3×10-7 |
| K2=5.6×10-11 |
| A. | 原溶液中:c(ClO-)>c(OH-)>c(H+) | |
| B. | 原溶液中:c(OH-)=c(H+)+c(HClO) | |
| C. | 反应后溶液中 c(HClO)>c(HCO3-)>c(ClO)>c(CO32-) | |
| D. | 反应后溶液中 c(Na+)=c(HCO3-)+c(CO32-)+c(H2CO3)+c(ClO-)+c(HClO) |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com