
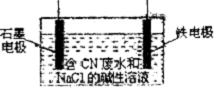
 金属铝、铁、铜及其化合物与生产、科研关系密切.
金属铝、铁、铜及其化合物与生产、科研关系密切.分析 (1)高温时,铝与二氧化锰发生置换反应生成锰,为铝热反应;
(2)根据发生的电极反应,可以知道金属铁是阴极,石墨电极是阳极,根据电解质中离子的放电顺序以及电极反应和电子的转移知识来回答即可;
(3)电解精炼铜时,粗铜作阳极,该电极上Zn、Fe、Ni、Cu失电子,精铜作阴极,该极上是铜离子得电子,阳极上铜以及比铜活泼的金属会溶解,而没有铜活泼的金属会从阳极掉落下,形成阳极泥;
(4)铝离子、铵离子水解使溶液显示酸性;根据铵离子水解使溶液显示酸性,硫酸铝铵溶液中氢离子浓度大于硫酸铝溶液的,氢离子抑制了铝离子的水解.
解答 解:(1)高温时,铝与二氧化锰发生置换反应生成锰,反应的方程式为3MnO2+4Al$\frac{\underline{\;高温\;}}{\;}$3Mn+2Al2O3,
故答案为:3MnO2+4Al$\frac{\underline{\;高温\;}}{\;}$3Mn+2Al2O3;
(2)①根据发生的电极反应,可以知道金属铁是阴极,接电源的负极,故答案为:负极;
②据氧化还原反应的原理,其反应方程式为3Cl2+2CNO-+8OH-═N2+6Cl-+2CO32-+4H2O,故答案为:N2;
③阴极上氢离子放电发生还原反应,生成氢气,阳极发生氧化反应,阳极的电极反应式为:CN--2e-+2OH-═CNO-+H2O和2Cl--2e-═Cl2↑,
故答案为:氢气;CN--2e-+2OH-═CNO-+H2O;
(3)a、电解池中,电能不会全部转化为化学能,还会伴随热能等形式的能的产生,故a错误;
b、电解精炼铜时,粗铜作阳极,接电源正极,发生氧化反应,故b正确;
c、溶液中Cu2+向阴极移动,在阴极上发生还原反应,故c错误;
d、在阳极上,没有铜活泼的金属Ag、Pt、Au等金属会从阳极掉落下,形成阳极泥,利用阳极泥可回收Ag、Pt、Au等金属,故d正确;
故答案为:ac;
(4)在硫酸铝铵溶液中,铝离子、铵离子水解,使溶液显示酸性,反应的离子方程式为:Al3+﹢3H2O?Al (OH)3﹢3H+; NH4++H2O?NH3•H2O+H+;根据铵离子水解使溶液显示酸性,硫酸铝铵溶液中氢离子浓度大于硫酸铝溶液的,氢离子抑制了铝离子的水解,况且浓度均为0.1mol•L-1硫酸铝和硫酸铝铵两种水溶液中,铝离子浓度分别为0.2mol/L和0.1mol/L,所以硫酸铝铵溶液中铝离子浓度较大;
故答案为:Al3+、NH4+; 硫酸铝铵.
点评 本题考查了铝热反应、电解原理及其应用、盐类水解,注意知识的归纳和整理以及应用是关键,难度不大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | 通CO的一极是电池的正极 | |
| B. | 该电池工作过程中需不断补充CO和O2,CO2可循环利用 | |
| C. | 负极反应式为:O2+2CO2+4e-→2CO32- | |
| D. | 正极反应式为:2CO+2CO32-→4CO2+4e- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 温度 | 250℃ | 300℃ | 350℃ |
| K | 2.041 | 0.270 | 0.012 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
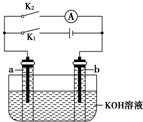 如图所示,a、b是多孔石墨电极,某同学按图示装置进行如下实验:断开K2,闭合K1一段时间,观察到两支玻璃管内都有气泡将电极包围,此时断开K1,闭合K2,观察到电流计A的指针有偏转.下列说法不正确的是( )
如图所示,a、b是多孔石墨电极,某同学按图示装置进行如下实验:断开K2,闭合K1一段时间,观察到两支玻璃管内都有气泡将电极包围,此时断开K1,闭合K2,观察到电流计A的指针有偏转.下列说法不正确的是( )| A. | 断开K2,闭合K1一段时间,溶液的pH变大 | |
| B. | 断开K1,闭合K2时,b极上的电极反应式为:2H++2e-═H2↑ | |
| C. | 断开K2,闭合K1时,a极上的电极反应式为:4OH--4e-═O2↑+2H2O | |
| D. | 断开K1,闭合K2时,OH-向b极移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HNO3溶液 | B. | NaOH溶液 | C. | H2SO4溶液 | D. | 盐酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 密闭容器中mA(g)+nB(g)?pC(g),反应达到平衡状态,经测定增大压强p时,A的转化率随p而变化的曲线如图所示:
密闭容器中mA(g)+nB(g)?pC(g),反应达到平衡状态,经测定增大压强p时,A的转化率随p而变化的曲线如图所示:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氧气通入氢硫酸 | B. | H2S缓慢通入饱和氯水 | ||
| C. | H2S缓慢通入亚硫酸 | D. | SO2缓慢通入氢硫酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 物质 | Fe(OH)3 | Cu(OH)2 | Ca(OH)2 | Mn(OH)2 | CuS | CaS | MnS | MnCO3 |
| pKp | 37.4 | 19.3 | 5.26 | 12.7 | 35.2 | 5.86 | 12.6 | 10.7 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com