
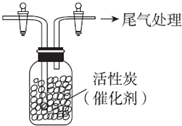
 某学习小组依据SO2具有还原性,推测SO2能被Cl2氧化生成SO2Cl2.
某学习小组依据SO2具有还原性,推测SO2能被Cl2氧化生成SO2Cl2.分析 (1)根据在化合物中,元素化合价的代数和为零进行解答;
(2)二氧化锰和浓盐酸反应生成氯气、二氯化锰和水;
(3)浓硫酸具有吸水性,可以干燥氯气;
(4)(1)①SO2Cl2与H2O反应生成硫酸和氯化氢;
②氯离子与银离子反应生成不溶液硝酸的氯化银沉淀,注意应先加入硝酸钡溶液,先排除硫酸根离子的干扰;
(2)SO2和Cl2生成SO2Cl2的反应为可逆反应,SO2Cl2分解得到的氯气和二氧化硫在水溶液中发生氧化还原反应生成硫酸和氯化氢,硫酸与氯化钡反应生成硫酸钡沉淀.
解答 解:(1)SO2Cl2中,氧为-2价,氯为-1价,根据在化合物中,元素化合价的代数和为零可知硫元素化合价为+6价,
故答案为:+6价;
(2)二氧化锰和浓盐酸反应生成二氯化锰、氯气和水,反应的方程式为:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O,
故答案为:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O;
(3)要收集干燥的氯气应除去氯气中的水蒸气,选用浓硫酸可以干燥氯气;
故答案为:浓硫酸;
(4)(1)①由于反应后溶液中阴离子只有硫酸根和氯离子,所以与水反应的产物为硫酸和盐酸,SO2Cl2与水反应的方程式为:SO2Cl2+2H2O=H2SO4+2HCl;
故答案为:SO2Cl2+2H2O=H2SO4+2HCl;
②要检验溶液中的氯离子应排除硫酸根离子的干扰,所以:取少量该溶液于试管中,加入过量Ba(NO3)2溶液,过滤,向滤液中滴加HNO3酸化,再加入AgNO3溶液,若产生白色沉淀,则说明溶液中有Cl-,
故答案为:取少量该溶液于试管中,加入过量Ba(NO3)2溶液,过滤,向滤液中滴加HNO3酸化,再加入AgNO3溶液,若产生白色沉淀,则说明溶液中有Cl-;
(2)SO2和Cl2生成SO2Cl2的反应为可逆反应,SO2Cl2分解得到的氯气和二氧化硫在水溶液中发生氧化还原反应生成硫酸和氯化氢,硫酸与氯化钡反应生成硫酸钡沉淀,
故答案为:①BaSO4;②SO2+Cl2=SO2 Cl2;由于白色沉淀是BaSO4,所以反应后的混合气体中必然存在SO2和Cl2两种气体.因此SO2和Cl2生成SO2Cl2的反应为可逆反应.
点评 本题为实验题,考查了二氧化硫的性质,题目难度中等,明确物质的性质是解题关键,注意离子检验的方法.


科目:高中化学 来源: 题型:选择题
| A. | C9H10O2 | B. | C9H12O2 | C. | C9H16O2 | D. | C9H18O2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在1 L 2 mol•L-1的硝酸镁溶液中含有的硝酸根离子数为2NA | |
| B. | 2.3 g Na变成Na+时失去的电子数目为0.2NA | |
| C. | 1 mol H2O的质量与NA个H2O的质量之和相等 | |
| D. | 在通常状况下,22.4 L O2与N2的混合物所含分子数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 食用油属于有机物,石蜡属于无机物 | |
| B. | 食用油属于纯净物,石蜡属于混合物 | |
| C. | 食用油属于酯类物质,石蜡属于烃类 | |
| D. | 食用油属于高分子化合物,石蜡属于小分子化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向NaAlO2溶液通入过量的CO2:2AlO2-+CO2+3H2O═2Al(OH)3↓+CO32- | |
| B. | 磁性氧化铁(Fe3O4)溶于氢碘酸:Fe3O4+2I-+8H+═3Fe2++I2+4H2O | |
| C. | 用FeS除去工业废水中的Hg2+:Hg2++S2-═HgS↓ | |
| D. | 向饱和的Ca(OH)2溶液中滴加过量NaHCO3溶液:HCO3-+Ca2++OH-═CaCO3↓+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
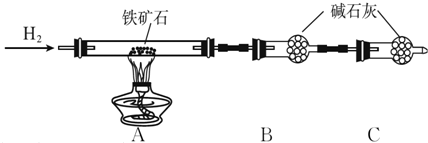
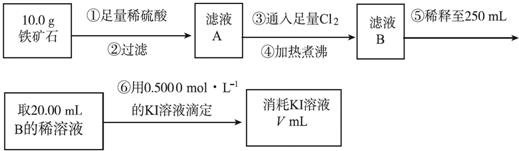
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③⑤⑦ | B. | ②④⑥⑦ | C. | ②③④⑤ | D. | ①③④⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
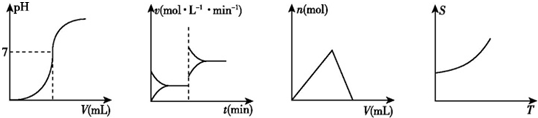
| A. | ①②③④ | B. | ②①③④ | C. | ③②②① | D. | ②③①④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 式量为30的碳、氢、氧组成的化合物无同分异构体 | |
| B. | 式量为128的烃的分子式不一定是C9H20 | |
| C. | 烃的式量可以是偶数,也可以是奇数 | |
| D. | 有机物分子中,H原子数可以是偶数,也可以是奇数 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com