
| A. | 第一次剩余4.8 g金属为铜和铁 | |
| B. | 稀硝酸的物质的量浓度为1.0 mol•L-1 | |
| C. | 原混合物中铜和铁各0.075 mol | |
| D. | 再加入上述100 mL稀硝酸,又得到标准状况下1.12 L NO |
分析 整个过程可以看作是9g铜和铁混合物与200mL硝酸反应生成0.1mol NO,金属完全溶解,向反应后的溶液中加入KSCN溶液,溶液不变红,说明生成硝酸亚铁、硝酸铜,且硝酸完全反应,发生的反应方程式为:3Fe+8HNO3=3Fe(NO3)2+2NO↑+4H2O;3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O,设铁为x mol,铜为ymol,根据二者质量与生成NO的体积列方程,再结合选项解答.
解答 解:整个过程可以看作是9g铜和铁混合物与200mL硝酸反应生成0.1mol NO,金属完全溶解,向反应后的溶液中加入KSCN溶液,溶液不变红,说明生成硝酸亚铁、硝酸铜,且硝酸完全反应,发生的反应方程式为:3Fe+8HNO3=3Fe(NO3)2+2NO↑+4H2O;3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O,设铁为x mol,铜为ymol,根据二者质量与生成NO的体积列方程,有:56x+64y=9、$\frac{2}{3}$(x+y)=$\frac{2.24}{22.4}$,联立方程,解得:x=0.075mol、y=0.075mol,
A.9g混合物中含铁质量为0.075mol×56g/mol=4.2g,含铜质量为0.075mol×64g/mol=4.8g,故第一次剩余金属4.8g为Cu的质量,故A错误;
B.根据方程式可知,n(HNO3)=0.075mol×$\frac{8}{3}$=0.2mol,稀硝酸的物质的量浓度为:$\frac{0.2mol}{0.1L}$=2mol/L,故B错误;
C.由上述分析可知,原混合物中铜和铁各0.075mol,故C正确;
D.再加入100mL该稀硝酸,亚铁离子与硝酸反应生成NO与硝酸铁,溶液中亚铁离子为0.075mol,根据电子转移守恒可知,亚铁离子完全反应,所以再加硝酸得NO为$\frac{0.075mol×1}{3}$=0.025mol,其体积为0.025mol×22.4L/mol=0.56L,故D错误;
故选C.
点评 本题考查混合物的有关计算,题目难度中等,利用整体法解答及判断最终的产物是关键,避免了过程法的繁琐,注意掌握守恒思想在化学计算中的应用方法,试题培养了学生的化学计算能力.


科目:高中化学 来源: 题型:解答题
 (用电子式表示).
(用电子式表示).查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 把浓硝酸放在棕色瓶中,并置于冷暗处保存 | |
| B. | 把Na保存在煤油中 | |
| C. | 把NaOH溶液放在带橡皮塞的玻璃瓶中 | |
| D. | 把氢氟酸放在玻璃瓶中 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
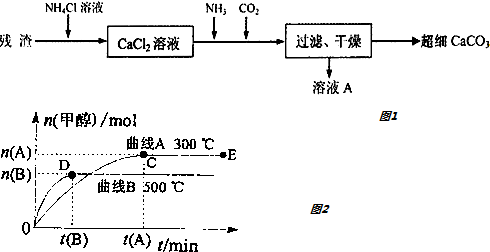
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ①④ | C. | ②③ | D. | ③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
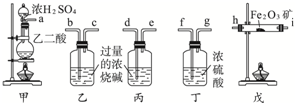
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2 | B. | 3 | C. | 4 | D. | 5 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com