
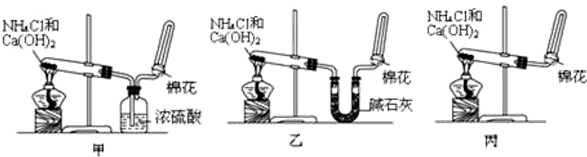
分析 实验室用氯化铵和氢氧化钙在加热条件下制备氨气,发生2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O,氨气为碱性气体,易与酸反应,可用碱石灰干燥,氨气密度比空气小,用向下排空法收集,且氨气的水溶液呈碱性,一般可用湿润的红色石蕊试纸或蘸有浓盐酸的玻璃棒检验,以此解答该题.
解答 解:①加热氯化铵和氢氧化钙固体生成氯化钙、氨气和水,化学方程式:2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O;
故答案为:2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O;
②甲同学用浓硫酸干燥氨气,氨气为碱性气体,能够与硫酸反应生成硫酸铵,方程式:2NH3+H2SO4=(NH4)2SO4,所以甲同学不能收集到气体;
故答案为:甲;2NH3+H2SO4=(NH4)2SO4;
③氨气的检验方法为:将湿润的红色石蕊试纸置于试管口,若试纸变蓝,则证明已收集满(或用蘸有浓盐酸的玻璃棒靠近试管口,若有白烟产生,则证明已收集满);
故答案为:将湿润的红色石蕊试纸置于试管口,若试纸变蓝,则证明已收集满(或用蘸有浓盐酸的玻璃棒靠近试管口,若有白烟产生,则证明已收集满).
点评 本题综合考查了氨气的制取、干燥及收集,为高频考点,侧重于学生的分析、实验能力的考查,注意根据氨气的性质选取干燥剂,根据氨气的溶解性及密度确定收集方法,知道形成喷泉实验的条件,并不是只有氨气才能形成喷泉实验,难度中等.


 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案科目:高中化学 来源: 题型:推断题
| 元素 | 相关信息 |
| X | X的基态原子核外只有三个能级,且各能级电子相等 |
| Y | Y的基态原子最外层电子数是其内层电子总数的三倍 |
| Z | Z的基态原子价电子排布为nsn-1 |
| W | W的单质是一种常见的红色金属,在潮湿的空气中易生成绿色的锈斑 |
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 .
. HSO3-+OH-(用离子方程式表示).
HSO3-+OH-(用离子方程式表示).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 离子浓度大小关系为c(Na+)>c(Cl-)>c(HS-)>c(H+)>c(OH-) | |
| B. | c(Na+)+c(H+)=c(Cl-)+c(HS-)+c(OH-) | |
| C. | c(HS-)+c(H2S)=0.04 mol/L | |
| D. | c(H+)-c(OH-)=0.02-c(H2S)+c(S2-) |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 实验 | 实验现象 | 结 论 |
A | 左烧杯中铁表面有气泡,右边烧杯中铜表面有气泡 | 活动性:Al>Cu>Fe |
B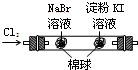 | 左边棉花变为橙色,右边棉花变为蓝色 | 氧化性:Cl2>Br2>I2 |
C | 白色固体先变为淡黄色,后变为黑色(Ag2S) | 溶解性:AgCl>AgBr>Ag2S |
D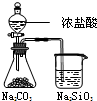 | 锥形瓶中有气体产生,烧杯中液体变浑浊 | 酸性:HCl>H2CO3>H2SiO3 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 42g乙烯和丙烯的混合气体中碳原子数目一定为3NA. | |
| B. | 用惰性电极电解CuSO4溶液后,如果加入 0.1 mol Cu(OH)2能使溶液复原,则电解时产生标准状况下1.12L的气体 | |
| C. | 配制一定物质的量浓度的NaOH溶液,把NaOH固体于烧杯中充分溶解,并迅速转移到容量瓶中定容 | |
| D. | 30g的NO与O2于密闭容器中充分反应,容器内的气体分子数为1 NA. |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 目前使用的元素周期表中,最长的周期含有18种元素 | |
| B. | 吸热且熵减的非自发反应在一定条件下也可以发生 | |
| C. | 浓硝酸具有强氧化性,常温下能够溶解铁 | |
| D. | 加过量难溶电解质MnS可除去MnCl2溶液中混有的Cu2+,说明MnS的溶解度小于CuS |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在AlCl3溶液中加入过量氨水:Al3++3NH3•H2O═Al(OH)3↓+3NH4+ | |
| B. | 在H2SO4溶液中加入Ba(OH)2溶液:Ba2++SO42-═BaSO4↓ | |
| C. | 氯气通入水中:Cl2+H2O═Cl-+ClO-+2H+ | |
| D. | 用稀硝酸洗涤试管内壁的银镜:Ag+2H++NO3-═Ag++NO↑+H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com