
【题目】将一定量氨基甲酸铵(NH2COONH4)加入密闭容器中,发生反应NH2COONH4(s)2NH3(g)+CO2(g)。该反应的平衡常数的负对数(-lgK)值随温度(T)的变化曲线如图所示,下列说法错误的是
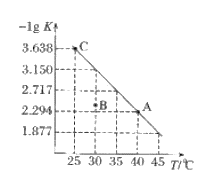
A. 该反应的△H>0
B. C点对应状态的平衡常数K(C)=103.638
C. NH3的体积分数不变时,该反应一定达到平衡状态
D. 30℃时,B点对应状态的![]()
【答案】C
【解析】
由图象可知,升高温度,平衡常数的负对数减小,说明升高温度K增大,平衡正向移动,则正反应为吸热反应,由化学方程式可知反应得到NH3、CO2的物质的量之比为2:1,反应开始后氨气体积分数始终不变,结合浓度商与平衡常数的关系判断反应的方向,以此解答该题。
A.-lgK越大,则平衡常数K越小,由图可知,随温度升高,平衡常数增大,则升高温度平衡正向移动,正反应为吸热反应,故该反应的△H>0,故A正确B.C点-lgK=3.638,则平衡常数K=10-3.638,故B正确;C.反应得到NH3、CO2的物质的量之比为2:1,反应开始后氨气体积分数始终不变,NH3的体积分数不变不能说明该反应达到平衡状态,故C错误;D.B点浓度商大于平衡常数,反应向逆反应进行,则B点对应状态的υ(正)<υ(逆),故D正确;故答案为C。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】酸性KMnO4、H2O2在生活、卫生医疗中常用作消毒剂,其中H2O2还可用于漂白,是化学实验室里必备的重要氧化试剂。高锰酸钾造成的污渍可用还原性的草酸(H2C2O4)去除,Fe(NO3)3也是重要的氧化试剂,下面是对这三种氧化剂性质的探究。
(1)某同学向浸泡铜片的稀盐酸中加入H2O2后,铜片溶解,写出该反应的离子方程式____________________,氧化产物与还原产物的物质的量之比为_______。
(2)取300 mL 0.2 mol·L-1的KI溶液与一定量的酸性KMnO4溶液恰好反应,生成等物质的量的I2和KIO3,则转移电子的物质的量是_____ mol。
(3)在Fe(NO3)3溶液中加入Na2SO3溶液,溶液先由棕黄色变为浅绿色,过一会又变为棕黄色,溶液先变为浅绿色的原因是_________________(用文字表达),又变为棕黄色的离子方程式是_____________________。
(4)测定KMnO4样品的纯度可用标准Na2S2O3溶液进行滴定,取0.474 g KMnO4样品溶解酸化后,用0.100 mol·L-1标准Na2S2O3溶液进行滴定,标准Na2S2O3溶液应盛装在___(填“酸式”或“碱式”)滴定管中。配平上述反应的离子方程式:___MnO4-+___S2O32-+____H+=____Mn2++_____SO42-+____H2O,实验中,滴定至终点时消耗Na2S2O3溶液12.00 mL,则该样品中KMnO4的物质的量是_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() 代表阿伏加德罗常数的值。下列说法正确的是( )
代表阿伏加德罗常数的值。下列说法正确的是( )
A. 2.24L水蒸气与足量的![]() 反应,生成氧气的分子数为0.05
反应,生成氧气的分子数为0.05![]()
B. 常温常压下,3.6![]() 中所含的中子数为2
中所含的中子数为2![]()
C. 0.1mol淀粉[(C6H10O5)n]完全水解消耗的水分子数为0.1![]()
D. 将0.1mol![]() 溶于适量水,溶液中
溶于适量水,溶液中![]() 粒子总数为0.1
粒子总数为0.1![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某品牌糖衣片补血剂,除去糖衣后显淡蓝绿色,主要成分是硫酸亚铁,不含其它铁的化合物.某研究性学习小组为测定该补血剂中硫酸亚铁的含量进行了如图1探究:
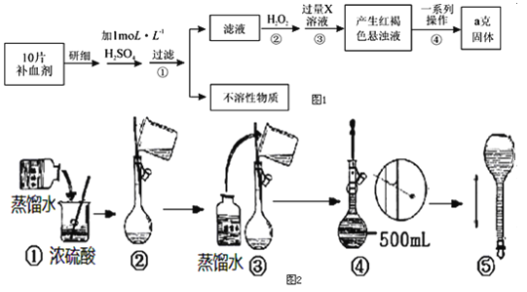
请回答下列问题:
Ⅰ实验时用10molL-1的浓硫酸配制100mL1molL-1H2SO4溶液,
(1)需用量筒量取____mL上述浓硫酸进行配制。
(2)所需的实验仪器有:①胶头滴管、②烧杯、③量筒、④玻璃棒,配制稀硫酸时,还缺少的玻璃仪器是____,该仪器所具备的功能是____(填序号)。
A.配制一定体积准确浓度的溶液
B.长期贮存溶液
C.常用来代替量筒量取一定体积的液体
D.用来溶解固体溶质
(3)在图2配制过程示意图中,错误的有(填序号)_____。
(4)下列操作导致所配制的稀硫酸的物质的量浓度偏低的是______填字母)。
A、用量筒量取浓硫酸时俯视凹液面
B、将浓硫酸稀释后未冷却至室温便将溶液转移至容量瓶
C、容量瓶用蒸馏水洗后未干燥
D、定容时仰视液面
E、未洗涤烧杯和玻璃棒
F、转移到容量瓶的过程中,有少量的溶液溅出
G、用量筒量取浓硫酸倒入小烧杯后,用蒸馏水洗涤量筒并将洗涤液转移至小烧杯中
H、用不干燥的量筒量取浓硫酸
Ⅱ(1)步骤③中产生的红褐色物质是(填化学式)_____。
(2)从红褐色的悬浊液到得到固体最后的称量,一系列过程中所需的基本操作为:
a.____,b.洗涤,c.灼烧,d.冷却。
(3)若称得固体的质量为ag,则每片补血剂中含硫酸亚铁的质量为____ g。
(4)写出步骤②的离子方程式:______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组制取氯酸钾和氯水并进行有关探究实验。
实验一 制取氯酸钾和氯水
利用如图所示的实验装置进行实验。

(1)制取实验结束后,取出B中试管冷却结晶,过滤,洗涤。该实验操作过程需要的玻璃仪器有______。
(2)若对调B和C装置的位置,_____(填“可能”或“不可能”)提高B中氯酸钾的产率。
实验二 氯酸钾与碘化钾反应的研究
(3)在不同条件下KClO3可将KI氧化为I2或KIO3。该小组设计了系列实验研究反应条件对反应产物的影响,其中系列a实验的记录表如下(实验在室温下进行):
试管编号 | 1 | 2 | 3 | 4 |
0.20molL-1KI/mL | 1.0 | 1.0 | 1.0 | 1.0 |
KClO3(s)/g | 0.10 | 0.10 | 0.10 | 0.10 |
6.0molL-1H2SO4/mL | 0 | 3.0 | 6.0 | 9.0 |
蒸馏水/mL | 9.0 | 6.0 | 3.0 | 0 |
实验现象 |
①系列a实验的实验目的是______。
②设计1号试管实验的作用是______。
③若2号试管实验现象是溶液变为黄色,取少量该溶液加入______溶液显蓝色。
实验三 测定饱和氯水中氯元素的总量
(4)根据下列资料,为该小组设计一个简单可行的实验方案(不必描述操作过程的细节):_____。
资料:①次氯酸会破坏酸碱指示剂;
②次氯酸或氯水可被SO2、H2O2和FeCl2等物质还原成Cl-。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:①Fe+H2SO4(稀)=FeSO4+H2↑
②Cu+2H2SO4(浓)![]() CuSO4+2H2O+SO2↑
CuSO4+2H2O+SO2↑
③KClO3+6HCl(浓)=KCl+3Cl2↑+3H2O。
试回答下列问题:
(1)当反应①转移3mol电子时,消耗H2SO4的质量是___g,产生氢气的体积(标准状况)_____L。
(2)反应②中_______作氧化剂,________是氧化产物。
(3)当反应②中生成11.2LSO2气体(标准状况下)时,被还原的H2SO4的物质的量是____。
(4)用双线桥法表示反应②电子转移的方向和数目(在化学方程式上标出)_______。
(5)反应③中氧化产物与还原产物的物质的量之比为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.充分燃烧2.8g某有机物A,生成8.8g CO2和3.6g H2O,这种有机物蒸气的相对密度是相同条件下N2的2倍。
(1)该有机物的分子式_______________,A的链状同分异构体共有__________种。
(2)A的链状同分异构体中含有支链的同分异构体的结构简式为_______________,其系统命名为__________________
(3)若该有机物跟HCl的加成产物只有一种,试确定其结构简式___________________
(4)若该有机物在核磁共振氢谱中只有一个信号峰(即只有一种氢原子),则用键线式表示的结构简式为___________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯化钠(NaCl)是生活中常用的化学品,也是重要的化工生产原料。
Ⅰ.实验室研究氯化钠的性质及制备
(1)氯化钠固体不导电,但氯化钠溶液能导电,用化学用语解释氯化钠溶液能导电的原因:___。
(2)实验室检验Cl-的试剂是___。
(3)某同学用含钠元素的不同类别物质制备NaCl。化学反应方程式如下:
a.2Na+Cl2![]() 2NaCl
2NaCl
b.Na2O+2HCl=2NaCl+H2O
c.
d.Na2CO3+2HCl=2NaCl+CO2↑+H2O
①请补充c反应的化学方程式:___。
②也可用两种盐溶液相互反应获得氯化钠,该反应的化学方程式为___。
Ⅱ.工业生产中氯化钠的制备
我国食盐的来源主要为海盐、湖盐、井矿盐。粗食盐中除了含泥沙等难溶性杂质外,还含有Ca2+、Mg2+、SO42-等可溶性杂质。某同学设计了一种制备精盐的实验方案,步骤如下:

(4)写出下列各试剂的化学式
试剂1:___;试剂2:___;试剂3:___。
(5)步骤④中涉及到的离子方程式有:___。
(6)步骤⑦涉及的操作是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作、现象和结论均正确的是( )
选项 | 实验操作 | 现象 | 结论 |
A | 植物油和溴水混合后振荡、静置 | 溶液分层,溴水褪色 | 植物油萃取了溴水中的Br2 |
B | 将硫酸酸化的H2O2滴入Fe(NO3)2溶液中 | 溶液变黄色 | H2O2的氧化性比Fe3+弱 |
C |
| 出现白色沉淀 | 氨气、二氧化碳与饱和食盐水反映生成碳酸钠 |
D | 将盛有铜与浓硫酸的试管加热,发现试管底部出现白色固体,倒去试管中液体,再加入适量水 | 白色固体溶解,溶液显蓝色 | 白色固体为无水硫酸铜 |
A. AB. BC. CD. D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com