
合成氨是最重要的化工生产之一,回答下列问题:
I.氢气通常用生产水煤气的方法制得。其中CO(g)+H2O(g)  CO2(g) + H2(g) △H<0,在 850℃时,平衡常数 K=1。
CO2(g) + H2(g) △H<0,在 850℃时,平衡常数 K=1。
(1)若升高温度到950℃时,达到平衡时K_________1(填“>”“<”或“ = ”)
(2)850℃时,若向一容积可变的密闭容器中同时充入1.0mol CO、3.0mol H2O、1.0mol CO2和xrnolH2,则:
①当x= 5.0时,上述平衡向_________(填正反应或逆反应)方向进行。
②若要使上述反应开始时向正反应方向进行,则x应满足的条件是_____________。
(3)在850℃时,若设x=5.0mol和x= 6.0mol,其它物质的投料不变,当上述反应达到平衡后,测得H2的体积分数分别为a%、b%,则a_______b(填“大于”、“小于”或“等于”)。
II.氨和尿素【CO(NH2)2】溶液都可以吸收硝酸工业尾气中的NO、NO2,将其转化为N2。
(4)尿素与NO、NO2三者等物质的最反应为:CO(NH2)2+NO+NO2=CO2+2N2+2H2O
该反应中的氧化剂为________(写化学式)。
若反应生成标况下N2 33.6L,则转移电子的数目为___________。
(5)已知:N2(g)+O2(g)=2NO(g)△H1=akJ ·mol-1
N2(g)+3H2(g) = 2NH3(g) △H2 = bkJ • mol-1
2H2(g) +O2(g) = 2H2O(g) △H3=ckJ • mol-1
则4NO(g)+4NH3(g)+O2(g)=4N2(g)+6H2O(g) △H=__________。
III.(6)合成氨盐也是氨的重要用途,测定其中的含氮量可以采用“甲醛法”。即4NH4++6HCHO (CH2)6N4+4H++6H2O。 现有一种纯净的铵盐,可能是硝酸铵、硫酸铵或碳酸铵中的一种。称取2g该铵盐溶于水,加入足量的甲醛溶液后,再加人水配成100mL溶液,取出10mL,滴入酚酞后再逐滴滴入0.lmol/L的NaOH溶液,当滴到25mL时溶液呈粉红色,且在半分钟内不褪色,则该铵盐中氮的质量分数是_________。
科目:高中化学 来源:2017届黑龙江哈尔滨三中高三上验收考试三化学卷(解析版) 题型:选择题
25℃时,下列说法不正确的是
A.物质的量浓度相等的盐酸和氨水等体积混合,所得溶液的pH<7
B.物质的量浓度相等的硫酸和氨水等体积混合,所得溶液的pH<7
C.pH=3的盐酸和pH=11的氨水等体积混合,所得溶液的pH>7
D.pH=3的硫酸和pH=11的氨水等体积混合,所得溶液的pH<7
查看答案和解析>>
科目:高中化学 来源:2016-2017学年浙江省高二上期中化学试卷(解析版) 题型:填空题
⑴室温时,pH=a的氨水与PH =b的盐酸等体积混合,恰好完全反应,则氨水电离度可表示为_______________ (用百分数来表示)
(2)室温下,0.1 mol/LNaClO溶液的pH_________0.1 mol/LNa2SO3溶液的pH。(选填“大于”、“小于”,或“等于”)。浓度均为0.1mol/L的Na2SO3和Na2CO3的混合溶液中,SO32-、CO32-、HSO3-、HCO3-浓度从大到小的顺序为 。
已知:
H2SO3 | Kal=1.54×l0-2 | Ka2=1.02×10-7 |
HCIO | Ka1=2.95×10-8 | |
H2CO3 | Kal=4.3×10-7 | Ka2=5.6×10-11 |
查看答案和解析>>
科目:高中化学 来源:2016-2017学年浙江省高二上期中化学试卷(解析版) 题型:选择题
25℃,1.01×105Pa时,反应:2N2O5(g) = 4NO2(g) +O2(g) △H = + 56.76 kJ·mol-1,能自发进行的原因是
A.是吸热反应 B.是放热反应 C.是熵减少的反应 D.熵增大效应大于能量效应
查看答案和解析>>
科目:高中化学 来源:2016-2017学年浙江省高二上期中化学试卷(解析版) 题型:选择题
mX(g)+nY(g)  qZ(g) △H<0, m+n>q,在恒容密闭容器中反应达到平衡时,下列说法正确的是
qZ(g) △H<0, m+n>q,在恒容密闭容器中反应达到平衡时,下列说法正确的是
A.通入稀有气体使压强增大,平衡将正向移动
B.X的正反应速率是Y的逆反应速率的m/n倍
C.降低温度,混合气体的平均相对分子质量变小
D.若平衡时X、Y的转化率相等,说明反应开始时X、Y的物质的量之比为n:m
查看答案和解析>>
科目:高中化学 来源:2017届安徽师大附中高三上新课标模拟化学卷(解析版) 题型:选择题
实验是化学研究的基础,关于下列各实验装置图的叙述中,正确的是
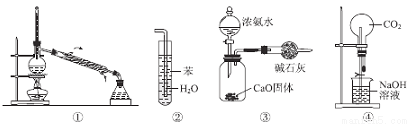
A.装置①常用于分离互不相溶的液体混合物
B.装置②可用于吸收氨气,且能够防止倒吸
C.装置③可用于制备少量NH3
D.装置④无法形成喷泉
查看答案和解析>>
科目:高中化学 来源:2016-2017学年辽宁东北育才学校高二上阶段考二化学卷(解析版) 题型:填空题
汽车尾气排放的一氧化碳、氮氧化物等气体已成为大气污染的主要来源:
(1)汽车发动机工作时会引发N2(g)+O2(g)=2NO(g)△H=+180kJ•mol﹣1,其能量变化示意图如下: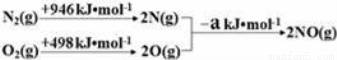
则NO中氮氧键的键能为 kJ•mol﹣1;
(2)空燃比过小易产生CO.有人提出可以设计反应2CO(g)=2C(s)+O2(g)来消除CO的污染.判断该设想是否可行 ,并说出理由
(3)利用活性炭涂层排气管处理NOx的反应为:xC(s)+2NOx(g)?N2(g)+xCO2 (g)△H=﹣b kJ•mol﹣1.若使NOx更加有效的转化为无毒尾气排放,以下措施理论上可行的是 ;
A.增加排气管长度 B.增大尾气排放口 C.升高排气管温度 D.添加合适的催化剂
(4)催化装置中涉及的反应之一为:2NO(g)+2CO(g)?N2(g)+2CO2(g).
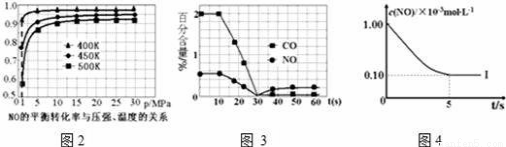
①探究上述反应中NO的平衡转化率与压强、温度的关系,得到图2所示的曲线.催化装置比较适合的温度和压强是 ;
②测试某型号汽车在冷启动(冷启动指发动机水温低的情况下启动)时催化装置内CO和NO百分含量随时间变化曲线如图3所示.则前10s 内,CO和NO百分含量没明显变化的原因是 ;
③研究表明:在使用等质量催化剂时,增大催化剂比表面积可提高化学反应速率.为了分别验证温度催化剂比表面积对化学反应速率的影响规律,某同学设计了以下三组实验:
实验编号 | T(K) | NO初始浓度 (mol•L﹣1) | CO初始浓度 (mol•L﹣1) | 催化剂的比表面积 (m2/g) |
Ⅰ | 400 | 1.00×10﹣3 | 3.60×10﹣3 | 82 |
Ⅱ | 400 | 1.00×10﹣3 | 3.60×10﹣3 | 124 |
Ⅲ | 450 | 1.00×10﹣3 | 3.60×10﹣3 | 124 |
根据坐标图4,计算400K时该反应的平衡常数为 ;
查看答案和解析>>
科目:高中化学 来源:2016-2017学年辽宁东北育才学校高二上阶段考二化学卷(解析版) 题型:选择题
一定条件下,CH4与H2O(g)发生反应:CH4(g)+H2O(g) CO(g)+3H2(g),设起始
CO(g)+3H2(g),设起始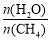 =Z,在恒压下,平衡时
=Z,在恒压下,平衡时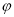 (CH4)的体积分数与Z和T(温度)的关系如图所示。下列说法正确的是
(CH4)的体积分数与Z和T(温度)的关系如图所示。下列说法正确的是
A.该反应的焓变ΔH>0
B.图中Z的大小为a>3>b
C.图中X点对应的平衡混合物中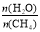 =3
=3
D.温度不变时,图中X点对应的平衡在加压后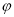 (CH4)减小
(CH4)减小
查看答案和解析>>
科目:高中化学 来源:2016-2017学年江苏省高一上月考二化学试卷(解析版) 题型:选择题
锂钒氧化物电池的能量密度远远超过其他材料电池,其成本低,便于大量推广,且对环 境无污染。电池总反应式为:V2O5+xLi=LixV2O5。下列说法中,不正确的是
境无污染。电池总反应式为:V2O5+xLi=LixV2O5。下列说法中,不正确的是
A.正极材料为锂,负极材料为V2O5
B.向外供电时,锂离子在凝胶中向正极移动
C.正极的电极反应式为:V2O5+xLi++xe-=LixV2O5
D.负极的电极反应式为:xLi-xe-=xLi+
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com