
金属钨用途广泛,主要用于制造硬质或耐高温的合金,以及灯泡的灯丝。高温下,在密闭容器中用H2还原WO3可得到金属钨,其总反应为:
WO3 (s) + 3H2 (g)  W
(s) + 3H2O (g) 请回答下列问题:
W
(s) + 3H2O (g) 请回答下列问题:
(1)在一定温度下进行上述反应,若反应容器的容积为0.5 L,2min后达到平衡,测得固体的质量减少了4.80 g,则H2的平均反应速率_________;该反应的平衡常数表达式K=___________
(2)某温度下反应达平衡时,H2与水蒸气的体积比为2:3,则H2的平衡转化率为__________;随温度的升高,H2与水蒸气的体积比减小,则该反应为 ____ (填“吸热”或“放热”) 反应。
(3)一定温度下,在密闭恒容的容器中,能表示上述反应达到化学平衡状态的是________。
A.混合气体的总压强保持不变 B.v正(H20)= v正(H2)
C.混合气体的密度保持不变 D.混合气体的平均式量保持不变
(4)钨丝灯管中的W在使用过程中缓慢挥发,使灯丝变细,加入I2可延长灯管的使用寿命,其工作原理为:W (s) +2I2 (g)  WI4
(g)。下列说法正确的有__________。
WI4
(g)。下列说法正确的有__________。
A.温度升高时,WI4的分解速率加快,W和I2的化合速率减慢
B.WI4在灯丝上分解,产生的W又沉积在灯丝上
C.WI4在灯管壁上分解,使灯管的寿命延长
D.灯管内的I2可循环使用
(1)0.3 mol/(L·min)或0.005 mol/(L·s)或1.8 mol/(L·h)(2分,单位不写扣1分) 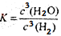 (1分)
(1分)
(2)60%。(1分) 正反应吸热(1分)。
(3)C( 1分)
(4)BD( 2分,一对一错不给分、漏1个给1分)
【解析】
试题分析:
(1)解:设氢气的物质的量为x
WO3 (s) + 3H2 (g)  W
(s) + 3H2O (g) ⊿m
W
(s) + 3H2O (g) ⊿m
3 48
x 4.8 x=0.3
V H2=0.3/0.5*2= 0.3 (mol/(L·min)) K=C3(H2O)/ C3(H2)
(2)解:设氢气的起始体积为a,变化体积为x
WO3 (s) + 3H2 (g)  W
(s) + 3H2O (g)
W
(s) + 3H2O (g)
初: a 0
变: x x
平: a-x x
(a-x)/ x=2/3 x=3a/5 H2的平衡转化率为x/a*100%=3a/5/ a*100%=60%
随温度的升高,H2与水蒸气的体积比减小,正向进行,正反应为吸热反应。
(3)A、前后气体系数相等,“混合气体的总压强保持不变”不能作为平衡标志,错误;B、同向的,不是标志,错误C、因不都是气体,虽体积不变,“混合气体的密度保持不变”只在平衡时,可做标志,正确;D、M=m/n, m和n始终不变,不是标志,错误。
(4)A、温度升高,速率都加快,错误;B、正确;C、寿命降低,错误。D、可逆反应,I2可升华,正确。
考点:本题以生活常识为基础,考查平衡常数、标志与平衡计算等知识。


科目:高中化学 来源: 题型:
| 高温 |
| c3(H2O) |
| c3(H2) |
| c3(H2O) |
| c3(H2) |
| 1400℃ |
| 约3000℃ |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| 高温 |
| c3(H2O) |
| c3(H2) |
| c3(H2O) |
| c3(H2) |
| 温度 | 25℃~550℃~600℃~700℃ |
| 主要成份 | WO3 W2O5 WO2 W |
| ||
| ||
| ||
| 约3000℃ |
查看答案和解析>>
科目:高中化学 来源:2012年普通高等学校招生全国统一考试理综化学部分(天津卷带解析) 题型:填空题
(14分)金属钨用途广泛,主要用于制造硬质或耐高温的合金,以及灯泡的灯丝。高温下,在密闭容器中用H2还原WO3可得到金属钨,其总反应为:
WO3 (s) + 3H2 (g)  W (s) + 3H2O (g)
W (s) + 3H2O (g)
请回答下列问题:
⑴ 上述反应的化学平衡常数表达式为___________________________。
⑵ 某温度下反应达平衡时,H2与水蒸气的体积比为2:3,则H2的平衡转化率为_____________________;随温度的升高,H2与水蒸气的体积比减小,则该反应为___________反应(填“吸热”或“放热”)。
⑶上述总反应过程大致分为三个阶段,各阶段主要成分与温度的关系如下表所示:
| 温度 | 25℃ ~ 550℃ ~ 600℃ ~ 700℃ |
| 主要成份 | WO3 W2O5 WO2 W |
 W (s) + 2H2O (g) ΔH= +66.0 kJ·mol-1
W (s) + 2H2O (g) ΔH= +66.0 kJ·mol-1 W (s) + 2H2O (g) ΔH = -137.9 kJ·mol-1
W (s) + 2H2O (g) ΔH = -137.9 kJ·mol-1 WO2 (g) 的ΔH = ______________________。
WO2 (g) 的ΔH = ______________________。 WI4 (g)。下列说法正确的有________________。
WI4 (g)。下列说法正确的有________________。查看答案和解析>>
科目:高中化学 来源:2012-2013学年广东省实验中学高二上学期期中化学试卷(带解析) 题型:填空题
(16分)金属钨用途广泛,主要用于制造硬质或耐高温的合金,以及灯泡的灯丝。高温下,在密闭容器中用H2还原WO3可得到金属钨,其总反应为:
WO3(s)+3 H2(g) W(s)+3 H2O(g)
W(s)+3 H2O(g)
请回答下列问题:
(1)上述反应的化学平衡常数表达式为
(2)某温度下反应达平衡时,随温度的升高, H2与水蒸气的体积比减小,则该反应为_____________反应(填 吸热或放热)
(3)上述总反应过程大致分为三个阶段,各阶段主要成分与温度的关系如下表所示:
| 温度 | 25 ℃ ~ 550 ℃ ~ 600℃ ~ 700℃ |
| 主要成分 | WO3 W2O5 WO2 W |
 W(s)+2H2O(g) ΔH=+66 kJ·mol-1
W(s)+2H2O(g) ΔH=+66 kJ·mol-1 W(s)+2H2O(g) ΔH= —137.9 kJ·mol-1
W(s)+2H2O(g) ΔH= —137.9 kJ·mol-1 WO2(g)的ΔH=_____ _______.
WO2(g)的ΔH=_____ _______.
查看答案和解析>>
科目:高中化学 来源:2012年普通高等学校招生全国统一考试理综化学部分(天津卷解析版) 题型:填空题
(14分)金属钨用途广泛,主要用于制造硬质或耐高温的合金,以及灯泡的灯丝。高温下,在密闭容器中用H2还原WO3可得到金属钨,其总反应为:
WO3 (s) + 3H2 (g)  W (s) + 3H2O (g)
W (s) + 3H2O (g)
请回答下列问题:
⑴ 上述反应的化学平衡常数表达式为___________________________。
⑵ 某温度下反应达平衡时,H2与水蒸气的体积比为2:3,则H2的平衡转化率为_____________________;随温度的升高,H2与水蒸气的体积比减小,则该反应为___________反应(填“吸热”或“放热”)。
⑶上述总反应过程大致分为三个阶段,各阶段主要成分与温度的关系如下表所示:
|
温度 |
25℃ ~ 550℃ ~ 600℃ ~ 700℃ |
|
主要成份 |
WO3 W2O5 WO2 W |
第一阶段反应的化学方程式为___________________________;580℃时,固体物质的主要成分为________;假设WO3完全转化为W,则三个阶段消耗H2物质的量之比为____________________________________。
⑷ 已知:温度过高时,WO2 (s)转变为WO2 (g);
WO2 (s) + 2H2 (g)  W (s) + 2H2O (g)
ΔH = +66.0 kJ·mol-1
W (s) + 2H2O (g)
ΔH = +66.0 kJ·mol-1
WO2 (g) + 2H2(g)  W (s) + 2H2O (g)
ΔH = -137.9 kJ·mol-1
W (s) + 2H2O (g)
ΔH = -137.9 kJ·mol-1
则WO2 (s)  WO2 (g) 的ΔH =
______________________。
WO2 (g) 的ΔH =
______________________。
⑸ 钨丝灯管中的W在使用过程中缓慢挥发,使灯丝变细,加入I2可延长灯管的使用寿命,其工作原理为:W (s) +2I2 (g) 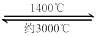 WI4 (g)。下列说法正确的有________________。
WI4 (g)。下列说法正确的有________________。
a.灯管内的I2可循环使用
b.WI4在灯丝上分解,产生的W又沉积在灯丝上
c.WI4在灯管壁上分解,使灯管的寿命延长
 d.温度升高时,WI4的分解速率加快,W和I2的化合速率减慢
d.温度升高时,WI4的分解速率加快,W和I2的化合速率减慢
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com