
【题目】磷酸氯喹是一种抗疟疾药物, 研究发现,该药在细胞水平上能有效抑制新型冠状病毒的感染。其合成路线如下:
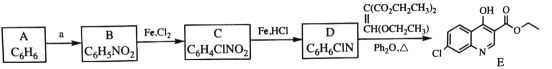

已知:

回答下列问题:
(1)A是一种芳香经, B 中官能团的名称为__________________。
(2)反应 A→B 中须加入的试剂a 为___________________。
(3)B 反应生成 C 的反应化学反应方程式是______________________。
(4)C→D 反应类型是_________, D的结构简式为_______________。
(5)F→G反应类型为________________。
(6)I是E的同分异构体,与E 具有相同的环状结构, 写出任意一种符合下列条件的I的结构简式是__________________________。
①I是三取代的环状有机物, 氯原子和羟基的取代位置与E相同;
②核磁共振氢谱显示I 除了环状结构上的氢外,还有4组峰, 峰面积比3:1:1:1;
③I加入NaHCO3溶液产生气体。
【答案】硝基 浓硫酸、浓硝酸  +Cl2
+Cl2 +HCl 还原反应
+HCl 还原反应  取代反应
取代反应 
【解析】
产物中含有苯环,则A是苯,B为硝基苯,B到C是一个取代反应,考虑到E中氮原子和氯原子处于间位,因此C是间硝基氯苯,D则是硝基被还原后变成了间氨基氯苯,E到F即题目信息中给出的反应,从F到G,分子式中少1个O和1个H,而多出了一个Cl,因此为一个取代反应,用氯原子取代了羟基,最后再进一步取代反应得到H,据此来分析本题即可。
(1)根据分析,B是硝基苯,其官能团为硝基;
(2)硝化反应需要用到浓硫酸和浓硝酸组成的混酸;
(3)B到C即取代反应,方程式为 +Cl2
+Cl2 +HCl;
+HCl;
(4)C到D是硝基被还原为氨基的过程,因此是一个还原反应,D为邻氨基氯苯,即 ;
;
(5)根据分析,F到G是一个取代反应;
(6)加入碳酸氢钠溶液能产生气体,因此分子中一定含有羧基,结合其它要求,写出符合条件的同分异构体,为 。
。


科目:高中化学 来源: 题型:
【题目】常温下,0.1mol/LH2C2O4水溶液中存在H2C2O4、HC2O4-和C2O42-三种形态含碳粒子,用NaOH或HCl调节该溶液的pH,三种含碳粒子的分布系数δ随溶液pH变化的关系如图[已知:a=1.35,b=4.17,Ksp(CaC2O4)=2.3×10-9,忽略溶液体积变化]。下列说法正确的是( )

A.pH=5时,溶液中主要含碳物种浓度大小关系为:c(C2O42-)>c(H2C2O4)>c(HC2O4-)
B.已知pKa=-lgKa,则pKa2(H2C2O4)=4.17
C.0.1mol·L-1NaHC2O4溶液中:c(H+)=c(OH-)+c(C2O42-)-c(H2C2O4)
D.一定温度下往CaC2O4饱和溶液中加入少量CaCl2固体,c(C2O42-)将减小,c(Ca2+)不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】砷化镓(GaAs)是优良的半导体材料,可用于制作微型激光器或太阳能电池的材料等。回答下列问题:
(1)写出基态As原子的核外电子排布式___________。
(2)AsCl3分子的立体构型为_________,其中As的杂化轨道类型为________。
(3)GaF3的熔点高于1000℃,GaCl2的熔点为77.9℃,其原因是______________。
(4)GaAs的熔点为1238℃,密度为ρ g/cm3,其晶胞结构如图所示。该晶体的类型为______________,Ga与As以______________键结合。Ga和As的摩尔质量分别为MGa g/mol和MAs g/mol,原子半径分别为rGa pm和rAs pm,阿伏加德罗常数值为NA,则GaAs晶胞中原子的体积占晶胞体积的百分率为______________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镍镉(Ni﹣Cd)可充电电池在现代生活中有广泛应用。电解质溶液为KOH溶液,电池反应为:Cd+2NiO(OH)+2H2O![]() Cd(OH)2+2Ni(OH)2,下列有关镍镉电池的说法正确的是( )
Cd(OH)2+2Ni(OH)2,下列有关镍镉电池的说法正确的是( )
A.充电过程是化学能转化为电能的过程
B.充电时阳极反应为Cd(OH)2+2e-=Cd+2OH-
C.放电时电池内部OH-向负极移动
D.充电时与直流电源负极相连的电极上发生Ni(OH)2转化为NiO(OH)的反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】汽车尾气中的CO和NO在排放时会发生复杂的化学反应。回答下列问题:
(1)通过NO传感器可监测汽车排放尾气中NO含量, 其工作原理如图所示。
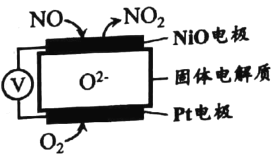
该传感器正极的电极反应式为 _________________。
(2)已知如下发生反应:
①2CO(g)+O2(g)=2CO2(g) △H1 =-606.6 kJ·mol-1
②2NO(g)+O2(g)=2NO2(g) △H2= -114.1 kJ·mo l-1
则反应CO(g) +NO2(g) = CO2(g) +NO(g)的△H =__________kJmo l-1
(3)300K时,将等浓度的CO 和 NO2混合加入刚性密闭容器中,发生反应CO(g) +NO2(g) = CO2(g) +NO(g), 测得 c(CO)浓度随时间t 的变化如表所示。
t/min | 0 | 20 | 90 | 170 | 560 | 1600 | 13200 | 14000 | ∞ |
c(CO)/mol·L-1 | 0.100 | 0.075 | 0.055 | 0.047 | 0.034 | 0.025 | 0.013 | 0.013 | 0.013 |
①300K时反应的平衡转化率α=_______%。平衡常数K=_______(保留1 位小数)。
②在300K下: 要提高CO转化率, 可采取的措施是_____________;要缩短反应达到平衡的时间,可采取的措施有______________、____________________。
③实验测得:反应物浓度按任意比时,该反应的正反应速率均符合v正=k正c2(NO2)。其中:k正为正反应速率常数,是与平衡常数K类似的只受温度影响的常数。请推理出v逆的表达式:v逆=_____________ (用k正 、 K 与c(CO)、c(CO2 )、c(NO)表达)。
④根据v逆的表达式 ,一定温度下,当反应达平衡后, t1时刻增大CO浓度, 平衡发生移动,下列图像正确的是______________。
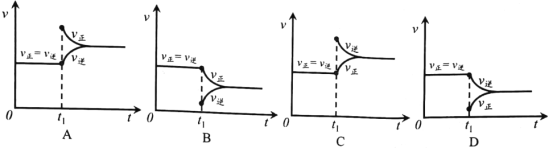
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将2molSO2和1molO2混合置于体积可变,压强恒定的密闭容器中,在一定温度下发生如下反应:2SO2(g)+O2(g)![]() 2SO3(g);△H<0,当反应进行到时间t1点时达到平衡状态,测得混合气体总物质的量为2.1mol。试回答下列问题:
2SO3(g);△H<0,当反应进行到时间t1点时达到平衡状态,测得混合气体总物质的量为2.1mol。试回答下列问题:
(1)反应进行到t1时,SO2的体积分数为__;
(2)若在t1时充入一定量的氩气(Ar),SO2的物质的量将__(填“增大”、“减小”或“不变”);
(3)若在t1时升温,重新达到平衡状态,新平衡混合物中气体的总物质的量_2.1mol(填“<”、“>”或“=”),简单说明原因:__。
(4)若t1达到平衡后,保持容器的体积不再变化。再加入0.2molSO2、0.1molO2和1.8molSO3,此时v逆_v正(填“<”、“>”或“=”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】庆祝新中国成立 70 周年阅兵式上,“东风-41 洲际弹道导弹”“歼 20”等护国重器闪耀亮相,它们都采用了大量合金材料。
回答下列问题:
(1)某些导弹的外壳是以碳纤维为增强体,金属钛为基体的复合材料。基态钛原子的外围电子排布式为_____。钛可与 C、N、O 等元素形成二元化合物,C、N、O 元素的电负性由大到小的顺序是_________。
(2)钛比钢轻,比铝硬,钛硬度比铝大的原因是_____。
(3)钛镍合金可用于战斗机的油压系统,该合金溶于热的硫酸生成 Ti(SO4)2、NiSO4,其中阴离子的立体构型为_____,S 的_____杂化轨道与 O 的 2p 轨道形成_____键(填 “π”或“σ”)。
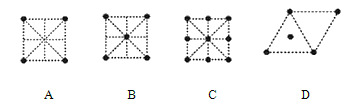
(4)金属钛采用六方最密堆积的方式形成晶体,其晶胞的俯视图为_____(填字母序号)。
(5)氮化钛熔点高,硬度大,其晶胞结构如图所示。
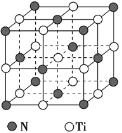
若氮化钛晶体中 Ti 原子的半径为 a pm,N 原子的半径为 b pm,则氮化钛晶体中原子的空间利用率的计算式为_____(用含 a、b 的式子表示)。碳氮化钛化合物在航天航空领域有广泛的应用,其结构是用碳原子代替氮化钛晶胞顶点的氮原子,则这种碳氮化钛化合物的化学式为_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下将NaOH溶液添加到己二酸(H2X)溶液中,混合溶液的pH与离子浓度变化的关系如图所示。下列叙述错误的是

A. Ka2(H2X)的数量级为10-6
B. 曲线N表示pH与 的变化关系
的变化关系
C. NaHX溶液中c(H+)>c(OH-)
D. 当混合溶液呈中性时,c(Na+)>c(HX-)>c(X2-)>c(H+)=c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】酪氨酸是一种生命活动不可缺少的氨基酸,它的结构简式如下:
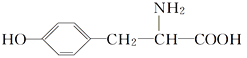
(1)酪氨酸能发生的化学反应类型有________(填字母)。
A.取代反应 B.氧化反应
C.酯化反应 D.中和反应
(2)在酪氨酸的同分异构体中,同时满足如下三个条件的,除酪氨酸外还有________种。
①属于氨基酸且“碳骨架”与酪氨酸相同;②与氯化铁溶液能发生显色反应;③氨基(—NH2)不与苯环直接相连。
(3)已知氨基酸能与碱反应,写出酪氨酸与足量的NaOH溶液反应的化学方程式:___________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com