
电解水时,可以加入少量电解质以增强导电性,下列物质中不宜加入的是( )
A.Na2SO4 B.NaOH
C.HCl D.H2SO4
 鸿图图书寒假作业假期作业吉林大学出版社系列答案
鸿图图书寒假作业假期作业吉林大学出版社系列答案科目:高中化学 来源: 题型:
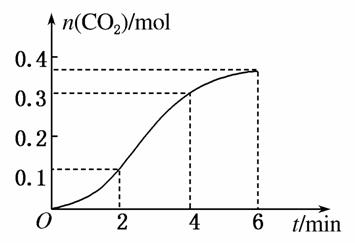
CaCO3与稀盐酸反应(放热反应)生成CO2的量与反应时间的关系如右图所示。下列结论不正确的是( )
A.反应开始4 min内温度对反应速率的影响比浓度大
B.一段时间后,反应速率减小的原因是c(H+)减小
C.反应在2~4 min内平均反应速率最大
D.反应在2~4 min内生成CO2的平均反应速率为v(CO2)=0.06 mol·L-1·s-1
查看答案和解析>>
科目:高中化学 来源: 题型:
向1.0 L 0.30 mol·L-1的NaOH溶液中缓慢通入8.8 g CO2气体,使其完全反应,对反应后的溶液,下列判断正确的是( )
A.溶质为Na2CO3
B.溶质为NaHCO3
C.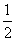 c(Na+)=c(HCO
c(Na+)=c(HCO )+c(CO
)+c(CO )+c(H2CO3)
)+c(H2CO3)
D.c(Na+)+c(H+)=c(HCO )+2c(CO
)+2c(CO )+c(OH-)
)+c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
物质在水溶液中可能存在电离平衡、盐的水解平衡或沉淀溶解平衡,它们都可看作化学平衡的一种。请根据所学化学知识回答下列问题:
(1)A为0.1 mol·L-1的(NH4)2SO4溶液,在该溶液中离子浓度由大到小的顺序为
________________________________________________________________________。
(2)B为0.1 mol·L-1的NaHCO3溶液,NaHCO3在该溶液中存在的平衡有(用离子方程式表
示)________________________________________________________________________
________________________________________________________________________。
(3)C为0.1 mol·L-1的(NH4)2Fe(SO4)2溶液,与同浓度的(NH4)2SO4溶液中相比较______(填溶质的化学式)溶液中NH 的浓度更大,其原因是
的浓度更大,其原因是
________________________________________________________________________
________________________________________________________________________。
(4)D为含有足量AgCl固体的饱和溶液,AgCl在溶液中存在如下平衡:AgCl(s)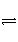
 Ag+(aq)+Cl-(aq)
Ag+(aq)+Cl-(aq)
在25 ℃时,AgCl的Ksp=1.8×10-10mol2·L-2。现将足量AgCl分别放入下列液体中:①100 mL蒸馏水 ②100 mL 0.3 mol·L-1 AgNO3溶液 ③100 mL 0.1 mol·L-1 MgCl2溶液充分搅拌后冷却到相同温度,Ag+浓度由大到小的顺序为______(填序号),此时溶液②中Cl-物质的量浓度为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
日本大地震、海啸引发多处核险情。下列说法中正确的是( )
A.核能是一种清洁、环保、安全的新能源
B.核变化属于化学变化
C.氢气的燃烧热最高,且来源丰富、无污染,是一级能源
D.将煤制成气体燃料或液体燃料,可以提高其燃烧效率
查看答案和解析>>
科目:高中化学 来源: 题型:
城市使用的燃料,现大多为煤气、液化石油气。煤气的主要成分是一氧化碳和氢气的混合气,它由煤炭与水(蒸气)反应制得,故又称水煤气。
(1)试写出制取水煤气的主要化学反应方程式______________。
(2)液化石油气的主要成分是丙烷,丙烷燃烧的热化学方程式为:
C3H8(g)+5O2(g)===3CO2(g)+4H2O(l) ΔH=-2220.0 kJ·mol-1
已知CO气体燃烧的热化学方程式为
CO(g)+ O2(g)===CO2(g)
O2(g)===CO2(g)
ΔH=-282.57 kJ·mol-1
试比较同物质的量的C3H8和CO燃烧,产生的热量比值约为________。
(3)已知氢气燃烧的热化学方程式为
2H2(g)+O2(g)===2H2O(l)
ΔH=-571.6 kJ·mol-1
试比较同质量的氢气和丙烷燃烧,产生的热量比值约为_____。
(4)氢气是未来的能源,除产生的热量多之外,还具有的优点是_________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
在铜催化和加热的条件下,用苯甲醇制得了苯甲醛,同时还有氢气生成。分离出铜后,检验所得苯甲醛是否为纯净物可用的方法是 ( )
A.测蒸气的摩尔体积 B.能否使酸性高锰酸钾溶液褪色
C.测熔点 D.能否发生银镜反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com